
| A. | 加入氯水振荡,观察水层是否有棕红色出现 | |
| B. | 滴入AgNO3溶液,再加入稀硝酸,观察有无浅黄色沉淀生成 | |
| C. | 加入NaOH溶液共热,然后加入稀硝酸使溶液呈酸性,再滴入AgNO3溶液,观察有无浅黄色沉淀生成 | |
| D. | 加入NaOH溶液共热,冷却后加入AgNO3溶液,观察有无浅黄色沉淀生成 |
分析 检验溴乙烷中溴元素,应在碱性条件下水解,最后加入硝酸酸化,加入硝酸银,观察是否有黄色沉淀生成,据此即可解答.
解答 解:检验溴乙烷中含有溴元素首先将它转化为溴离子,采用卤代烃的水解方法,即加入氢氧化钠,在水解后生成的溴离子可以和银离子反应,生成淡黄色不溶于硝酸的沉淀溴化银,由此来检验溴乙烷中的溴元素,所以操作为:加入NaOH溶液,加热,溴乙烷在碱性条件下水解生成溴化钠和乙醇,冷却,加入稀HNO3酸化后加入AgNO3溶液,溴离子和银离子反应生成淡黄色不溶于硝酸的溴化银沉淀.
故选C.
点评 本题是一道考查检验某溴乙烷中的溴元素的实验题,考查实验分析能力,依据相关实验证实即可解答,难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 第七周期0族 | B. | 第六周期第IA族 | C. | 第八周期第ⅡA族 | D. | 第七周期第ⅦA族 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 油脂经皂化反应后,生成高级脂肪酸钠,甘油和水形成混合液 | |
| B. | 加入食盐可以使肥皂析出,这一过程叫盐析 | |
| C. | 加入食盐搅拌后,静置一段时间,溶液分成上下两层,下层是高级脂肪酸钠 | |
| D. | 皂化反应后的混合溶液中加入食盐,可以通过过滤的方法分离提纯 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
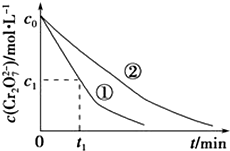 某酸性工业废水中含有K2Cr2O7.光照下,草酸(H2C2O4)能将其中的Cr2O72-转化为Cr3+.某课题组研究发现,少量铁明矾[Al2Fe(SO4)4•24H2O]即可对该反应起催化作用.为进一步研究有关因素对该反应速率的影响,探究如下:
某酸性工业废水中含有K2Cr2O7.光照下,草酸(H2C2O4)能将其中的Cr2O72-转化为Cr3+.某课题组研究发现,少量铁明矾[Al2Fe(SO4)4•24H2O]即可对该反应起催化作用.为进一步研究有关因素对该反应速率的影响,探究如下:| 实验编号 | 初始pH | 废水样品体积/mL | 草酸溶液体积/mL | 蒸馏水体积/mL |
| ① | 4 | 60 | 10 | 30 |
| ② | 5 | 60 | 10 | 30 |
| ③ | 5 | 60 |
| 实验方案(不要求写具体操作过程) | 预期实验结果和结论 |
| 用等物质的量K2SO4•Al2(SO4)3•24H2O代替实验①中的铁明矾,控制其他反应条件与实验①相同,进行对比实验 | 反应进行相同时间后,若溶液中c(Cr2O72-)大于实验①中c(Cr2O72-),则假设一成立;若两溶液中的c(Cr2O72-)相同,则假设一不成立 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素原子的核外电子排布呈周期性变化 | |
| B. | 元素的化合价呈周期性变化 | |
| C. | 元素原子的金属性、非金属性呈周期性变化 | |
| D. | 元素的原子半径呈周期性变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应物总能量低于生成物总能量时,该反应一定不能发生 | |
| B. | 化学键的键能越大,物质的能量越高 | |
| C. | 一个反应的焓变因反应物的用量和反应条件的改变而发生改变 | |
| D. | 应用盖斯定律,可计算某些难以直接测量的反应焓变 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com