
【题目】今有常温下两种溶液:①0.1mol/LNH3·H2O溶液②0.1mol/LNH4Cl溶液
(1)溶液①的PH______7(填“>”、“<”或“=”),写出NH3·H2O的电离方程式______________。
(2)溶液②呈________性(填“酸”、“碱”或“中”)。
(3)关于两种溶液中c(NH4+)的大小叙述正确的是________(填序号)。
A.两种溶液中c (NH4+)都等于0.lmol/L
B.两种溶液中c (NH4+)都小于0.lmol/L
C.NH4Cl溶液中c(NH4+)小于NH3·H2O溶液中c(NH4+)
(4)将溶液中①逐滴加入溶液②中,当溶液pH=7时,c(NH4+)______ c(Cl一)(填“>”、“<”或“=”)。
【答案】 > NH3·H2O![]() NH4++OH- 酸 B =
NH4++OH- 酸 B =
【解析】考查弱电解质的电离和盐类水解,以及电荷守恒,(1)NH3·H2O属于弱碱,NH3·H2O![]() NH4++OH-,溶液显碱性,即pH>7;(2)NH4Cl属于强酸弱碱盐,NH4++H2O
NH4++OH-,溶液显碱性,即pH>7;(2)NH4Cl属于强酸弱碱盐,NH4++H2O![]() NH3·H2O+H+,溶液显酸性;(3)A、NH3·H2O属于弱碱,部分电离,因此NH4+浓度小于0.1mol·L-1,NH4Cl属于强酸弱碱盐,NH4+发生水解,因此NH4+浓度小于0.1mol·L-1,故A错误;B、根据选项A的分析,故B正确;C、NH3·H2O的电离和NH4+的水解都是微弱的,因此NH4Cl溶液中c(NH4+)大于NH3·H2O中NH4+的浓度,故C错误;(4)根据电荷守恒,c(NH4+)+c(H+)=c(Cl-)+c(OH-),因为溶液pH=7,即c(H+)=c(OH-),因此c(NH4+)=c(Cl-)。
NH3·H2O+H+,溶液显酸性;(3)A、NH3·H2O属于弱碱,部分电离,因此NH4+浓度小于0.1mol·L-1,NH4Cl属于强酸弱碱盐,NH4+发生水解,因此NH4+浓度小于0.1mol·L-1,故A错误;B、根据选项A的分析,故B正确;C、NH3·H2O的电离和NH4+的水解都是微弱的,因此NH4Cl溶液中c(NH4+)大于NH3·H2O中NH4+的浓度,故C错误;(4)根据电荷守恒,c(NH4+)+c(H+)=c(Cl-)+c(OH-),因为溶液pH=7,即c(H+)=c(OH-),因此c(NH4+)=c(Cl-)。


科目:高中化学 来源: 题型:
【题目】下列事实的解释中错误的是
A. 在蔗糖中加入浓硫酸后出现发黑现象,说明浓硫酸具有脱水性
B. 浓硫酸和浓盐酸混合可制氯化氢,说明浓硫酸具有吸水性
C. 常温下能够用铝罐储存浓硫酸,是因为浓硫酸的强氧化性可使铝发生钝化
D. 反应:C+2H2SO4(浓)![]() CO2↑+2H2O+2SO2↑中,H2SO4既体现酸性又体现了强氧化性
CO2↑+2H2O+2SO2↑中,H2SO4既体现酸性又体现了强氧化性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁被称为“国防金属”,镁及其合金用途很广,目前世界上60%的镁从海水中提取。从海水中提取镁的流程如下:
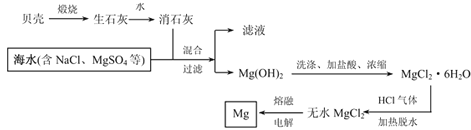
请根据上述流程图和镁及化合物的性质回答下列问题:
(1)用贝壳煅烧生石灰的反应方程式:________________
(2)氢氧化镁溶于盐酸的离子方程式为:_____________。
(3)简述,由MgCl2·6H2O制无水MgCl2,加热时通HCl气体的主要原因是:___________。
(4)金属镁属于(填写下列编号):___________。
a.黑色金属 b.有色金属 c.轻金属 d.重金属 e.贵金属
(5)Mg(OH)2煅烧可得熔点很高的MgO,MgO的电子式为:____________。
(6)MgCl2和AlCl3的熔点均较低,加MgO和Al2O3的熔点都很高。为什么冶炼金属镁是电解MgCl2,而冶炼金属铝则电解Al2O3:_______________。
(7)某MgCl2溶液的浓度为0.01mol/L,在该溶液中滴加NaOH溶液至pH=10,此时溶液中的Mg2+是否沉淀完全?_________(填“是”或“否”),此时c(Mg2+)=_________。
(已知:Ksp[Mg(OH)2]=1.8×10-11)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C是中学化学中常见的三种物质,它们之间的相互转化关系如下(部分反应条件及产物略去):

(1)若A是一种金属,C是淡黄色固体,则B的化学式为 _____________________,A→C反应的化学方程式为______________________。
(2)若A是一种非金属,其常见单质为黑色固体,C是最重要的温室气体,则C的分子式是___________,B→C反应的化学方程式为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】浓度为0.50mol·L-1的某金属阳离子Mn+的溶液10.00mL,与0.40mol·L-1的NaOH溶液12.50mL完全反应,生成沉淀,则n等于
A. 1 B. 2 C. 3 D. 4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能源短缺是人类社会面临的重大问题。甲醇是一种可再生能源,具有广泛的开犮和应用前景。工业上通过媒的气化生成的CO和H2合成甲醇,反应原理为:CO(g)+2H2(g) ![]() CH3OH(g)
CH3OH(g)
(1)在一容积可变的密闭容器中充有10 mol CO和20mol H2,在催化剂作用下发生反应生成甲醇。CO的平衡转化率(a)与温度(T)、压强(p)的关系如图1所示。
①合成甲醇的反应为_____(填“放热”或“吸热”)反应。判断理由是_________。平衡常数KA_____KC(填“>”、“<”或“=”)。
②下列有关该反应的说法正确的是_____(填字母序号)。
A.当v(CO)生成=2v消耗(H2) 时该反应达到平衡状态
B.其它条件不变,只改变CO和H2的投料量,该反应的焓变发生改变
C.在反应过程中混合气体的密度和相对平均分子质量均不发生变化
D.使用催化剂可以减小反应的活化能
(2)下列措施可以提高甲醇产率的是________。
A.压缩容器体积
B.恒容条件下充入He,使体系总压强增大
C.将CH3OH (g)从体系中分离
D.恒压条件下再充入10mol CO和20mol H2
(3)甲醇一一空气燃料电池装置如图2所示。
①该电池甲电极的电极反应式为_________。
②若用此甲醇燃料电池电解200mL —定浓度NaCl与CuSO4的混合溶液(电极为惰性电极,不参与反应),电极产生气体体积(标况下)与电解时间的关系图如图3所示,此溶液中硫酸铜的浓度为______mol/L。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com