
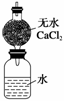
ijУѧ������С��Ϊ�ⶨNaԪ�ص����ԭ����������Ƶ�װ����ͼ����װ��(����ˮ�����)��������Ϊa g����ʵ����ȡ��b g(������)���Ʒ���ˮ�У�����ƿ������ȫ��Ӧ���ٳ�����װ�õ�������Ϊc g���Իش�
(1)ʵ����ȡ��һС���ƣ���Ҫ�õ�_________________________________________��
(2)�˸���ܵ�������___________________________________________________��
�����ƿ��м����������������������ԭ���������ʵ�����ԭ������__________(�ƫ����ƫС�����䡱����ͬ)��
(3)�м�ͬѧ������ͼ�и����������һͬ������ܣ���Ŀ����_____________�������Ƶ����ԭ�������ı���ʽΪ__________��
(4)����ͬѧΪ���������ж�����Ѹ�ٲ���ƫ��ֽ����ڼ���ƿ���ټ���һ����ú�ͣ���Ŀ����___________________________________________________________________
________________________________________________________________________��
 ��ɢ˼ά�¿���ϵ�д�
��ɢ˼ά�¿���ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����˵������ȷ����
�ٽ�BaSO4����ˮ�в��ܵ��磬����BaSO4�Ƿǵ����
�ڰ�����ˮ�õ��İ�ˮ�ܵ��磬����ˮ�ǵ����
�۹�̬���ۻ����ﲻ���磬����̬�Ĺ��ۻ�������Ե���
�ܹ�̬�����ӻ����ﲻ���磬����̬�����ӻ�����Ҳ������
��ǿ�������Һ�ĵ�������һ�������������Һ�ĵ�������ǿ
A���٢ܡ��� ��B���٢ܢ� C���٢ڢۢ� D���٢ڢۢܢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
ijУ��ѧ��ȤС����ʵ�����з���һƿ��Һ����ǩ�ϱ��С�CaCl2,0.1 mol��L��1���������������Ǹ�С���Ա�Ը���Һ����������ȷ����(����)
A������1 L����Һ���ɽ�0.1 mol CaCl2����1 Lˮ��
B��Ca2����Cl�������ʵ���Ũ�ȶ���0.1 mol��L��1
C�����Լ�ƿ��ȡ����Һ��һ�룬��������Һ�����ʵ���Ũ��Ϊ0.05 mol��L��1
D������ƿ��Һϡ��һ������������Һ��c(Cl��)Ϊ0.1 mol��L��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����ʵ�������ȷ����(����)
A����ʢˮ���ձ���Ͷ��СĴָ��С���ƿ飬�۲�����
B�����Ʊ�����������
C����һС���Ʒ���ʯ�����ϼ��ȣ��۲�����
D����������һ������ƣ��۲��Ƶ���ɫ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��һ��ƶ�����С�Ľ�����Ͷ�뵽ʢ������ͭ��Һ���ձ���۲������������������йع۲��¼������������������(����)
A���Ƹ���Һ���ϣ��ۻ���������С��
B���Ƹ���Һ���Ͼ�ֹ����
C����Һ��ð���˴�������ɫ����
D����Һ���������ɫ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
ʪ�����ɫʯ����ֽ�Ӵ�����������ɫ�仯Ϊ(����)
A�����
B���ȱ�����ɫ
C����ɫ
D������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����ˮ�ֱ���뵽������Һ�У��۲��кα仯��д���йط�Ӧ�Ļ�ѧ����ʽ��
(1)��ɫʯ����Һ______________________��
________________________________________________________________________��
(2)̼������Һ__________________________________________________________��
________________________________________________________________________��
(3)��������Һ___________________________________________________________��
________________________________________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����������Ũ�����Ũ��������Ѿ�ƽ�����ƽ��(��ͼ��ʾ),��¶���ڿ�����һ��ʱ��,��������������ȷ����(����)
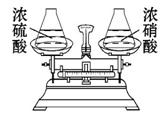
A.��ƽ��Ȼƽ��
B.ʢŨ�����һ���³�
C.��������Һ�зֱ�Ͷ������ľ̿,����Ӧ������������
D.����������Һ��Ũ�Ⱦ���С
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�������������ʡ�����ȵ���Ҫԭ�ϣ�Χ�ƺϳɰ����ǽ�����һϵ���о�
��1�����������뵪������������������Ӧ�����Ƿ�Ӧ������ȴ����ͬ��
|
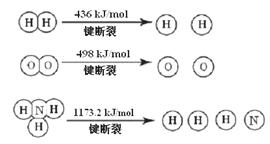
��1�� �������1 mol N��N����Ҫ���� kJ �� ���������л�ѧ�������������еĻ�ѧ���� ���ǿ�����������������������߷�Ӧ��������ͬ��
��2���̵��ǿ�ѧ�������о�����Ҫ���⡣��Ȼ���д�����Ȼ�Ĵ����̵����̣�
N2 (g) + O2 (g) = 2NO (g) ��H = +180.8 kJ/mol ����ҵ�ϳɰ������˹��̵���
�������̵ֹ���Ӧ��ƽ�ⳣ�������н�����ȷ���� ��
| ��Ӧ | �����̵� | ��ҵ�̵� | ||||
| �¶�/�� | 27 | 2000 | 25 | 350 | 400 | 450 |
| K | 3.84��10-31 | 0.1 | 5��108 | 1.847 | 0.507 | 0.152 |
A�������£������̵����������ܽ��У�����ҵ�̵��dz�������
B��������ģģ������̵����������
C����ҵ�̵��¶�Խ�ͣ�������������ӦԽ��ȫ
D��KԽ��˵���ϳɰ���Ӧ������Խ��
��3���ں��º����ܱ������а��ռס������ַ�ʽ�ֱ�Ͷ�ϣ����ʵ������±�����ʾ��������Ӧ��3H2 (g) + N2 (g)  2NH3 (g)��ü�������H2��ת����Ϊ40%��
2NH3 (g)��ü�������H2��ת����Ϊ40%��
| N2 | H2 | NH3 | |
| �� | 1 | 3 | 0 |
| �� | 0.5 | 1.5 | 1 |
 ��3H2 (g) + N2 (g)
��3H2 (g) + N2 (g)  2NH3 (g)��ƽ�ⳣ������ʽ
2NH3 (g)��ƽ�ⳣ������ʽ
���ж��������з�Ӧ���еķ��� �������������
��4�������Ǻϳ������ԭ�ϣ�д��������������Ӧ����һ����������̬ˮ���Ȼ�ѧ����ʽ ��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com