
【题目】利用太阳能热化学硫碘循环分解水制氢反应过程如下图所示:
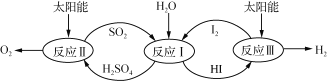
(1) 反应Ⅱ中涉及的热化学方程式为:
①H2SO4(l)=SO3(g)+H2O(g) ΔH=+177.3 kJ·mol-1
②2SO3(g) = 2SO2(g)+O2(g) ΔH=a kJ·mol-1
③2H2SO4(l)=2SO2(g)+O2(g)+2H2O(g) ΔH=+550.2 kJ·mol-1则 a= ;
(2)反应Ⅰ得到的产物可用I2进行分离。该产物的溶液在过量I2的存在下会分成两层 :含低浓度I2的H2SO4溶液层和高浓度的I2的HI溶液层。
①区分两层溶液可加入的试剂为 (填化学式)。
②下列说法正确的是 (填序号)。
A. SO2在反应Ⅰ中作氧化剂
B. 加过量I2前,H2SO4溶液和HI不互溶
C. 两层溶液的密度存在差异
D. I2在HI溶液中比在H2SO4溶液中易溶
(3)用氧缺位铁酸铜(CuFe2O4-x)作催化剂,利用太阳能热化学循环分解H2O也可制H2,其物质转化如右图所示。
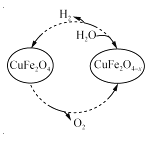
①氧缺位铁酸铜(CuFe2O4-x)与水反应的化学方程式为 。
②若x=0.15,则1 mol CuFe2O4参与该循环过程理论上一次能制得标准状况下的H2体积为 L。
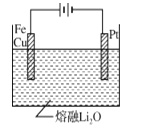
③CuFe2O4可用电化学方法得到,其原理如图所示,则阳极的电极反应式为 。
【答案】(1)195.6(2)①BaCl2②CD
(3)①CuFe2O4-x+xH2O=CuFe2O4+xH2②3.36
③Cu+2Fe+4O2--8e-=CuFe2O4
【解析】
试题分析:(1) 已知:①H2SO4(l)=SO3(g)+H2O(g) ΔH=+177.3 kJ·mol-1
②2SO3(g)=2SO2(g)+O2(g) ΔH=a kJ·mol-1
③2H2SO4(l)=2SO2(g)+O2(g)+2H2O(g) ΔH=+550.2 kJ·mol-1
则根据盖斯定律可知③-①×2即得到反应②,所以a=550.2-177.3×2=195.6;
(1)①由于含有硫酸,因此区分两层溶液可加入的试剂为BaCl2;②A.S元素化合价升高,SO2在反应Ⅰ中作还原剂,A错误;B.加I2前,H2SO4溶液和HI溶液互溶,与分层无关,B错误;C.两层溶液的密度存在差,才出现上下层,C正确;D. .I2在HI溶液中比在H2SO4溶液中易溶,则碘在不同溶剂中溶解性不同,类似萃取,与分层有关,D正确,答案选CD。
(3)①根据转化关系图可知氧缺位铁酸铜(CuFe2O4-x)与水反应生成氢气和CuFe2O4,所以反应的化学方程式为CuFe2O4-x+xH2O=CuFe2O4+xH2;
②根据①中反应的方程式可知若x=0.15,则1 mol CuFe2O4参与该循环过程理论上一次能制得标准状况下的H2体积为0.15mol×22.4L/mol=3.36L。
③电解池中阴离子向阳极移动,即O2-向阳极移动,阳极是金属失去电子,结合O2-生成CuFe2O4,因此阳极的电极反应式为Cu+2Fe+4O2--8e-=CuFe2O4;


科目:高中化学 来源: 题型:
【题目】通过溶解、过滤、蒸发等操作,可将下列各组混合物分离的是( )
A. 硝酸钠、氢氧化钠 B. 氧化铜、二氧化锰
C. 氯化钾、二氧化锰 D. 硫酸铜、氢氧化钙
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁-次氯酸盐电池的工作原理如图,该电池反应为:
Mg+ClO-+H20=Mg(0H)2+Cl-。下列有关说法正确的是

A.电池工作时,正极a附近的pH将不断增大
B.电池工作时,C溶液中的溶质是MgCl2
C.负极反应式:ClO- +2e- +H20 = Cl- +20H-
D.b电极发生还原反应,每转移0.2mol电子,理论上生成0.1 mol Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(9分)某化学兴趣小组对生石灰与水反应是显著放热反应进行了实验探究,在除了用手触摸试管壁感觉发热外,还设计了下列几个可行性方案。
甲方案:将温度计与盛放有生石灰的小试管用橡皮筋捆绑在一起,放入有水的小烧杯中,用胶头滴管向小试管中缓缓滴入水,看到的现象是 ,说明反应放热。(下列装置中支撑及捆绑等仪器已略去)

乙方案:将盛放有生石灰的小试管插入带支管的试管中,支管接①或②,用胶头滴管向小试管中缓缓滴入水,看到的现象是(接①) ,(接②) ,说明反应放热。
丙方案:用胶头滴管向盛放有生石灰且带支管的试管中滴加水,支管接的导管中盛适量无水硫酸铜粉末,看到的现象是 ,说明反应放热,其原因是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CuSO4是一种重要的化工原料,其有关制备途径及性质如图所示。下列说法正确的是
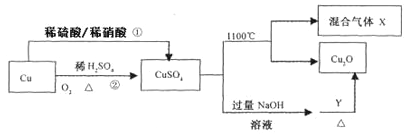
A.途径①和途径②都体现了硫酸的酸性和氧化性
B.Y可以是酒精溶液
C.CuSO4在1100℃分解所得气体X可能是SO2和SO3的混合气体
D.将CuSO4溶液蒸发浓缩、冷却结晶,可制得胆矾晶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究FeCl3溶液中的离子平衡和离子反应,某小组同学进行了如下实验。
(1)配制50 mL 1.0 mol·L1的FeCl3溶液,测其pH约为0.7,即c(H+) = 0.2 mol·L1。
① 用化学用语解释FeCl3溶液呈酸性的原因: 。
② 下列实验方案中,能使FeCl3溶液pH升高的是 (填字母序号)。
a. 加水稀释 b. 加入FeCl3固体
c. 滴加浓KSCN溶液 d. 加入NaHCO3固体
(2)小组同学利用上述FeCl3溶液探究其与足量锌粉的反应。实验操作及现象如下:
操作 | 现象 |
向反应瓶中加入6.5 g锌粉,然后加入50 mL 1.0 mol·L1的FeCl3溶液,搅拌 | 溶液温度迅速上升,稍后出现红褐色沉淀,同时出现少量气泡;反应一段时间后静置,上层溶液为浅绿色,反应瓶底部有黑色固体 |
收集检验反应过程中产生的气体 | 集气管口靠近火焰,有爆鸣声 |
已知:Zn的性质与Al相似,能发生反应:Zn + 2NaOH = Na2ZnO2 + H2 ↑
① 结合实验现象和平衡移动原理解释出现红褐色沉淀的原因: 。
② 用离子方程式解释反应后溶液为浅绿色的原因: 。
③ 分离出黑色固体,经下列实验证实了其中含有的主要物质。
i. 黑色固体可以被磁铁吸引;
ii. 向黑色固体中加入足量的NaOH溶液,产生气泡;
iii. 将ii中剩余固体用蒸馏水洗涤后,加入稀盐酸,产生大量气泡;
iv. 向iii反应后的溶液中滴加KSCN溶液,无变化。
a. 黑色固体中一定含有的物质是 。
b. 小组同学认为上述实验无法确定黑色固体中是否含有Fe3O4,理由是 。
(3)为进一步探究上述1.0 mol·L1 FeCl3溶液中Fe3+和H+氧化性的相对强弱,继续实验并观察到反应开始时现象如下:
操作 | 现象 |
将5 mL 1.0 mol·L1的FeCl3溶液与0.65 g锌粉混合 | 溶液温度迅速上升,开始时几乎没有气泡 |
将 与0.65 g锌粉混合 | 溶液中立即产生大量气泡 |
小组同学得出结论:在1.0 mol·L1 FeCl3溶液中,Fe3+的氧化性比H+更强。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com