
| 选项 | 项目 | 结论 |
| A | 丙烯、氯乙烯、苯 | 分子内所有原子均共面 |
| B | 由溴丙烷制丙醇;由丙烯制丙醇 | 属同种反应类型 |
| C | 乙烯和苯加入溴水中,水层褪色 | 褪色原理相同 |
| D | C4H9Cl的同分异构体数目(不考虑立体异构) | 共4种 |
| A、A | B、B | C、C | D、D |


 直通贵州名校周测月考直通名校系列答案
直通贵州名校周测月考直通名校系列答案科目:高中化学 来源: 题型:
| A、HCN溶液和NaOH溶液不等体积混合后一定存在c(H+)-c(OH-)=c(CN-)-c(Na+) |
| B、等温下,等浓度的CH3COONa溶液和NaCN溶液的pH,后者大 |
| C、常温下,pH相同的CH3COOH溶液和HCN溶液分别加水稀释相同的倍数时,前者pH的变化小 |
| D、溶液中由水电离出的c(H+),前者是后者的10m-n倍 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 离子 | Cu2+ | H+ | Cl- | SO42- |
| c/mol?L-1 | 0.5 | 2 | 2 | 0.5 |

查看答案和解析>>
科目:高中化学 来源: 题型:
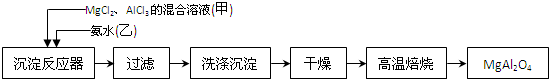
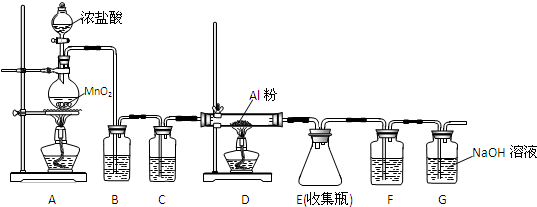
查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CaCl2溶液 |
| B、AgNO3溶液 |
| C、NaOH溶液 |
| D、稀H2SO4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com