
 铬、钒、镨(Pr)、铈(Ce)等金属在工农业生产中有广泛的应用.
铬、钒、镨(Pr)、铈(Ce)等金属在工农业生产中有广泛的应用.分析 (1)根据铬的核外电子排布规律可知,铬在最外层是N层,有2个电子,据此答题;
(2)根据反应Cr2O3+2Al$\frac{\underline{\;高温\;}}{\;}$2Cr+Al2O3是放热,利用反应热△H=反应物的总键能-生成物的总键能来解答;分子晶体中分子间存在范德华力;
(3)两原子形成共价键时,有且仅有一个为σ键,其它为π键,丙烯分子中碳原子周围有三个σ键,没有孤电子对,据此判断;
(4)PrO2(二氧化镨)的晶体结构与CaF2相似,晶胞中Pr(镨)原子位于面心和顶点,以晶胞顶点的Pr原子为例,与之距离最近的氧原子位于立方体的体对角线上,每个顶点为8故晶胞共用,根据均摊法计算晶胞中Pr原子数目,再根据化学式中原子数目之比计算晶胞中O原子数目;
(5)铈(Ce)单质为面心立方晶体,所以晶胞的面对角线应等于Ce原子半径的4倍,据此计算;利用均摊法计算晶胞中Ce原子数目,可以计算晶胞质量,根据ρ=$\frac{m}{V}$计算密度.
解答 解:(1)铬的核外电子排布式为1s22s22p63s23p63d54s1,所以铬在最外层是N层,有1个电子,N层上原子轨道为spdf四种,共有轨道数为1+3+5+7=16,价电子排布式为3d54s1,
故答案为:N;16;3d54s1;
(2)反应Cr2O3+2Al$\frac{\underline{\;高温\;}}{\;}$2Cr+Al2O3是放热,△H<O,由反应热△H=反应物的总键能-生成物的总键能可知Cr-O键的键能小于Al-O键,Al-O稳定性更强,分子晶体中分子间存在范德华力,所以固态氯化铝晶体类型是分子晶体;
故答案为:Al-O;分子晶体;
(3)两原子形成共价键时,有且仅有一个为σ键,其它为π键,根据V2O5的结构式可知,V2O5分子含 6个σ键和4个π键,丙烯分子中连有双键的碳原子周围有三个σ键,没有孤电子对,甲基中的碳有4个σ键,所以丙烯分子中碳原子的杂化方式为sp2、sp3,
故答案为:6;4;sp2、sp3;
(4)PrO2(二氧化镨)的晶体结构与CaF2相似,晶胞中Pr(镨)原子位于面心和顶点,晶胞中Pr原子数目=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,而Pr原子与O原子数目之比为1:2,则晶胞中O原子数目为4×2=8,以晶胞顶点的Pr原子为例,与之距离最近的氧原子位于立方体的体对角线上,每个顶点为8故晶胞共用,Pr的配位数为8,
故答案为:8;8;
(5)铈(Ce)单质为面心立方晶体,所以晶胞的面对角线应等于Ce原子半径的4倍,所以铈原子(Ce)半径r为$\frac{\sqrt{2}×516}{4}$pm;
晶胞中铈原子位于顶点和面心,数目为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,晶胞质量为4×$\frac{140}{6.02×10{\;}^{23}}$g,该晶胞体积为(516×10-10cm)3,则密度ρ=4×$\frac{140}{6.02×10{\;}^{23}}$g÷(516×10-10cm)3=$\frac{4×140}{6.02×10{\;}^{23}×(516×10{\;}^{-10}){\;}^{3}}$g•cm-3,
故答案为:$\frac{\sqrt{2}×516}{4}$;$\frac{4×140}{6.02×10{\;}^{23}×(516×10{\;}^{-10}){\;}^{3}}$.
点评 本题考查较为综合,涉及核外电子排布、原子结构、化学键、晶体类型、晶胞的结构及晶体计算等知识,题目难度中等,侧重考查对基础知识的应用,需要学生具备扎实的基础,难度中等.


 名师金手指领衔课时系列答案
名师金手指领衔课时系列答案科目:高中化学 来源: 题型:解答题
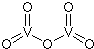
 ,你认为该分子是否为平面形分子?否(填“是”或“否”).
,你认为该分子是否为平面形分子?否(填“是”或“否”).
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 自然界存在丰富的碳、氮、硅、磷、铁等元素,它们可形成单质及许多化合物.按要求回答下列问题:
自然界存在丰富的碳、氮、硅、磷、铁等元素,它们可形成单质及许多化合物.按要求回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 混合物中含有0.05molFe元素 | |
| B. | 该硝酸溶液中溶质的质量分数是63% | |
| C. | 所加入NaOH溶液的体积最少是450mL | |
| D. | 反应中HNO3被氧化,生成氧化产物NO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单质的还原性:W>X>Y | |
| B. | 原子半径:X>Y>Z>W | |
| C. | X的最高价氧化物对应水化物的碱性比Y的弱 | |
| D. | 化合物XYW4具有强氧化性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 离子 | Cu2+ | Al3+ | NO3- | Cl- |
| 物质的量浓度(mol/L) | 1 | 1 | a | 1 |
| A. | 阳极生成1.5mol Cl2 | B. | a=3 | ||
| C. | 电解后溶液中c(H+)=1moL/L | D. | 阴极析出的金属是铜与铝 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
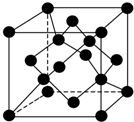
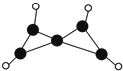 科学家最近在-100℃的低温下合成一种烃X,此分子的结构如图所示(图中的连线表示化学键).下列说法不正确的是( )
科学家最近在-100℃的低温下合成一种烃X,此分子的结构如图所示(图中的连线表示化学键).下列说法不正确的是( )| A. | X在常温下不能稳定存在 | |
| B. | X的性质与烯烃类似,容易发生加成反应 | |
| C. | X不能使酸性KMnO4溶液褪色 | |
| D. | 充分燃烧等质量的X和甲烷,X消耗氧气比甲烷少 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
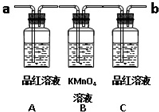 已知二氧化硫可使高锰酸钾溶液褪色,用如图装置(部分装置没画出)来验证某混合气体中同时含有SO2和CO2.
已知二氧化硫可使高锰酸钾溶液褪色,用如图装置(部分装置没画出)来验证某混合气体中同时含有SO2和CO2.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
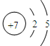 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com