
| A. | 味精 | B. | 食盐 | C. | 亚硝酸钠 | D. | 苯甲酸钠 |
分析 A、味精作为食品制作过程中的调味剂;
B、氯化钠具有咸味,用食盐腌制食品可以防止食品腐烂变质;
C、亚硝酸钠作为肉类的发色剂、防腐剂;
D、苯甲酸钠是很常用的食品防腐剂;
解答 解:A、味精作为食品制作过程中的调味剂,不具有防腐的作用,故A错误;
B、食盐是一种常用的咸味调味剂,用食盐腌制食品可以防止食品腐烂变质,所以食盐是一种食品防腐剂,故B正确;
C、亚硝酸钠作为肉类的发色剂、防腐剂,不具有调味的作用,故C错误;
D、苯甲酸钠是很常用的食品防腐剂,有防止变质发酸、延长保质期的效果,在世界各国均被广泛使用,但不具备调味剂的功能,故D错误;
故选:B.
点评 本题考查了常见食品添加剂的性质和作用,完成此题,可以依据物质的性质进行,平时注意知识的积累,题目较简单.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:实验题

| 电离能/kJ•mol-1 | I1 | I2 | I3 | I4 |
| A | 578 | 1817 | 2745 | 11578 |
| B | 738 | 1451 | 7733 | 10540 |
| 离子晶体 | NaCl | KCl | CaO |
| 晶格能/kJ•mol-1 | 786 | 715 | 3401 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验室制备肥皂,利用花生油与稀硫酸混合液在小烧杯中加热,直到油滴消失 | |
| B. | 配置菲林试剂,在硫酸铜溶液中加入少量的氢氧化钠溶液 | |
| C. | 检验卤代烃消去反应的有机产物:1-溴丙烷和NaOH的乙醇溶液混合后加热,将产生的蒸汽直接通入酸性高锰酸钾溶液,观察是否褪色 | |
| D. | 鉴别汽油和植物油:向汽油和植物油中分别加入一定量NaOH溶液加热振荡,观察油层是否消失或变薄 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有②④⑤ | B. | 只有①③④ | C. | 只有①②③⑤ | D. | ①②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质子数为53、中子数为78的碘原子:${\;}_{53}^{131}$I | |
| B. | N2的电子式: | |
| C. | S2-的结构示意图: | |
| D. | 甲烷分子的比例模型是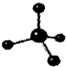 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
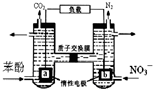 我国科学家构建了一种双室微生物燃料电池,以苯酚(C6H6O)为燃料,同时消除酸性废水中的硝酸盐.下列说法正确的是:( )
我国科学家构建了一种双室微生物燃料电池,以苯酚(C6H6O)为燃料,同时消除酸性废水中的硝酸盐.下列说法正确的是:( )| A. | a为正极 | |
| B. | 若右池产生0.672L气体(标况下),则转移电子0.15mol | |
| C. | 左池电极反应式为C6H6O+11H2O-28e-═6CO2↑+28H+ | |
| D. | 左池消耗的苯酚与右池消耗的NO3-的物质的量之比为28:5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子化合物AB | B. | 离子化合物B2A3 | C. | 离子化合物B(AO3)2 | D. | 离子化合物A2BO3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com