”¾“š°ø”æ
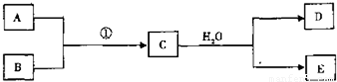
·ÖĪö£ŗ£Ø1£©ČōĢõ¼ž¢ŁĪŖµćČ¼£¬ÄæĒ°60%µÄB¶¼ŹĒ“Óŗ£Ė®ÖŠĢįČ”µÄ£¬ŌņBŹĒMg£¬ĘųĢåDæÉŅŌŹ¹ŹŖČóµÄŗģÉ«ŹÆČļŹŌÖ½±äĄ¶£¬ŌņDŹĒNH
3£¬CŗĶĖ®·“Ӧɜ³É°±ĘųŗĶE£¬øł¾ŻŌŖĖŲŹŲŗćÖŖ£¬AÖŠŗ¬ÓŠµŖŌŖĖŲ£¬MgŗĶµŖĘųÄÜ·¢ÉśÉś³ÉµŖ»ÆĆ¾£¬ĖłŅŌAŹĒµŖĘų£¬µŖ»ÆĆ¾ŗĶĖ®·“Ӧɜ³É°±ĘųŗĶĒāŃõ»ÆĆ¾£¬¾Ż“ĖŠ“³ö·“Ó¦·½³ĢŹ½£»
¼īŠŌ°±ĘųČ¼ĮĻµē³ŲÖŠ£¬øŗ¼«ÉĻ°±ĘųŹ§µē×Ó·¢ÉśŃõ»Æ·“Ó¦£»
£Ø2£©ČōĢõ¼ž¢ŁĪŖ¼ÓČČ£¬EŹĒŅ»ÖÖĮ½ŠŌĒāŃõ»ÆĪļ£¬ŌņEŹĒĒāŃõ»ÆĀĮ£¬ĘųĢåDŹĒŅ»ÖÖÓŠ³ō¼¦µ°ĘųĪ¶µÄĘųĢ壬ĘäĖ®ČÜŅŗŹĒ»¹ŌŠŌĖį£¬ŌņDŹĒĮņ»ÆĒā£¬øł¾ŻŌŖĖŲŹŲŗćÖŖ£¬CŹĒĮņ»ÆĀĮ£¬Įņ»ÆĒāŹĒ¶žŌŖĖį£¬ŗĶµČĪļÖŹµÄĮæµÄĒāŃõ»ÆÄĘ·“Ӧɜ³ÉĮņĒā»ÆÄĘ£¬¾Ż“ĖŠ“³ö·“Ó¦·½³ĢŹ½£»
£Ø3£©ČōĢõ¼ž¢ŁĪŖ³£ĪĀ£¬BŗĶDĪŖĶ¬-ÖÖĪŽÉ«ĘųĢ壬³£ĪĀĻĀEµÄÅØČÜŅŗæÉŅŌŹ¹Fe¶Ū»Æ£¬ŌņEŹĒĻõĖį£¬DŹĒŅ»Ńõ»ÆµŖ£¬CŹĒ¶žŃõ»ÆµŖ£¬AŹĒŃõĘų£¬ÉŁĮæFe·ŪŗĶÅØĻõĖį·“Ӧɜ³ÉĻõĖįĢś”¢¶žŃõ»ÆµŖŗĶĖ®£»
ĄūÓĆøĒĖ¹¶ØĀɼĘĖć£®
½ā“š£ŗ½ā£ŗ£Ø1£©ČōĢõ¼ž¢ŁĪŖµćČ¼£¬ÄæĒ°60%µÄB¶¼ŹĒ“Óŗ£Ė®ÖŠĢįČ”µÄ£¬ŌņBŹĒMg£¬ĘųĢåDæÉŅŌŹ¹ŹŖČóµÄŗģÉ«ŹÆČļŹŌÖ½±äĄ¶£¬ŌņDŹĒNH
3£¬CŗĶĖ®·“Ӧɜ³É°±ĘųŗĶE£¬øł¾ŻŌŖĖŲŹŲŗćÖŖ£¬AÖŠŗ¬ÓŠµŖŌŖĖŲ£¬MgŗĶµŖĘųÄÜ·¢ÉśÉś³ÉµŖ»ÆĆ¾£¬ĖłŅŌAŹĒµŖĘų£¬µŖ»ÆĆ¾ŗĶĖ®·“Ӧɜ³É°±ĘųŗĶĒāŃõ»ÆĆ¾£¬ĖłŅŌĘä·“Ó¦·½³ĢŹ½ĪŖ£ŗMg
3N
2+6H
2O=3Mg£ØOH£©
2+2NH
3”ü£»
¼īŠŌ°±ĘųČ¼ĮĻµē³ŲÖŠ£¬øŗ¼«ÉĻ°±ĘųŹ§µē×Ó·¢ÉśŃõ»Æ·“Ó¦£¬µē¼«·“Ó¦Ź½ĪŖ£ŗ2NH
3+6OH
--6e
-=N
2ӟ+6H
2O£¬
¹Ź“š°øĪŖ£ŗMg
3N
2+6H
2O=3Mg£ØOH£©
2+2NH
3”ü£»2NH
3+6OH
--6e
-=N
2ӟ+6H
2O£»
£Ø2£©ČōĢõ¼ž¢ŁĪŖ¼ÓČČ£¬EŹĒŅ»ÖÖĮ½ŠŌĒāŃõ»ÆĪļ£¬ŌņEŹĒĒāŃõ»ÆĀĮ£¬ĘųĢåDŹĒŅ»ÖÖÓŠ³ō¼¦µ°ĘųĪ¶µÄĘųĢ壬ĘäĖ®ČÜŅŗŹĒ»¹ŌŠŌĖį£¬ŌņDŹĒĮņ»ÆĒā£¬øł¾ŻŌŖĖŲŹŲŗćÖŖ£¬CŹĒĮņ»ÆĀĮ£¬Įņ»ÆĒāŹĒ¶žŌŖĖį£¬ŗĶµČĪļÖŹµÄĮæµÄĒāŃõ»ÆÄĘ·“Ӧɜ³ÉĮņĒā»ÆÄĘ£¬ĖłŅŌĄė×Ó·“Ó¦·½³ĢŹ½ĪŖ£ŗH
2S+OH
-=HS
-+H
2O£¬¹Ź“š°øĪŖ£ŗH
2S+OH
-=HS
-+H
2O£»
£Ø3£©ČōĢõ¼ž¢ŁĪŖ³£ĪĀ£¬BŗĶDĪŖĶ¬-ÖÖĪŽÉ«ĘųĢ壬³£ĪĀĻĀEµÄÅØČÜŅŗæÉŅŌŹ¹Fe¶Ū»Æ£¬ŌņEŹĒĻõĖį£¬DŹĒŅ»Ńõ»ÆµŖ£¬CŹĒ¶žŃõ»ÆµŖ£¬AŹĒŃõĘų£¬ÉŁĮæFe·ŪŗĶÅØĻõĖį·“Ӧɜ³ÉĻõĖįĢś”¢¶žŃõ»ÆµŖŗĶĖ®£¬·“Ó¦·½³ĢŹ½ĪŖ£ŗFe+6HNO
3£ØÅØ£©
Fe£ØNO
3£©
3+3NO
2ӟ+3H
2O£»
³£ĪĀĻĀAÓėB·“Ӧɜ³É1molCµÄģŹ±äĪŖ-57.07kJ/mol£¬ĘäČČ»Æѧ·“Ó¦·½³ĢŹ½ĪŖ£ŗ2NO+O
2=2NO
2”÷H=-114.14kJ/mol¢Ł£¬
1molCÓėH
2O·“Ӧɜ³ÉĘųĢåDŗĶEČÜŅŗµÄģŹ±äĪŖ-46kJ/mol£¬ĘäČČ»Æѧ·“Ó¦·½³ĢŹ½ĪŖ3NO
2+H
2O=2HNO
3+NO”÷H=-138kJ/mol¢Ś£¬
½«·½³ĢŹ½¢Ł×3+¢Ś×2µĆ4NO£Øg£©+3O
2£Øg£©+2H
2O£Øl£©=4HNO
3£Øaq£©”÷H=£Ø-114.14kJ/mol£©×3+£Ø-138kJ/mol£©×2=618.42kJ/mol£¬
¹Ź“š°øĪŖ£ŗFe+6HNO
3£ØÅØ£©
Fe£ØNO
3£©
3+3NO
2ӟ+3H
2O£»4NO£Øg£©+3O
2£Øg£©+2H
2O£Øl£©=4HNO
3£Øaq£©”÷H=-618.42kJ/mol£®
µćĘĄ£ŗ±¾Ģāæ¼²éŌŖĖŲ»ÆŗĻĪļµÄŠŌÖŹ£¬ÕżČ·ĶʶĻĪļÖŹŹĒ½ā±¾Ģā¹Ų¼ü£¬Ć÷Č·ĪļÖŹµÄĢŲŹāŠŌÖŹ¼“æɽā“š£¬ÄѶČÖŠµČ£®

 Fe£ØNO3£©3+3NO2”ü+3H2O£»
Fe£ØNO3£©3+3NO2”ü+3H2O£» Fe£ØNO3£©3+3NO2”ü+3H2O£»4NO£Øg£©+3O2£Øg£©+2H2O£Øl£©=4HNO3£Øaq£©”÷H=-618.42kJ/mol£®
Fe£ØNO3£©3+3NO2”ü+3H2O£»4NO£Øg£©+3O2£Øg£©+2H2O£Øl£©=4HNO3£Øaq£©”÷H=-618.42kJ/mol£®

 ĆĻ½ØĘ½“ķĢā±¾ĻµĮŠ“š°ø
ĆĻ½ØĘ½“ķĢā±¾ĻµĮŠ“š°ø ³¬ÄÜѧµäÓ¦ÓĆĢāĢāæØĻµĮŠ“š°ø
³¬ÄÜѧµäÓ¦ÓĆĢāĢāæØĻµĮŠ“š°ø


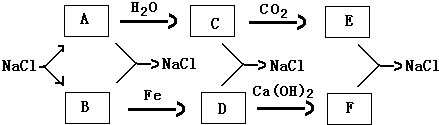
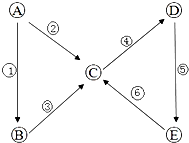 ŅŌĻĀ¶¼ŹĒĪŅĆĒÉś»ī”¢Ń§Ļ°ÖŠ³£¼ūµÄĪļÖŹ£¬Ēė°“ÕÕŅŖĒó»Ų“šĻą¹ŲĪŹĢā£ŗ
ŅŌĻĀ¶¼ŹĒĪŅĆĒÉś»ī”¢Ń§Ļ°ÖŠ³£¼ūµÄĪļÖŹ£¬Ēė°“ÕÕŅŖĒó»Ų“šĻą¹ŲĪŹĢā£ŗ