

 2CuO,固体质量应该增加,说明一定发生,固体分成两等份,在空气中充分灼烧后,所得固体为CuO,固体增重0.96 g,则参加反应的n(O)=0.06 mol,转移的电子数为0.12 mol,另一份与H2O2酸性溶液反应,得蓝色溶液,说明产物为Cu2+,转移电子数应与前一份相同为0.12 mol,H2O2被还原为H2O,1mol过氧化氢转移2mol电子,根据得失电子守恒
2CuO,固体质量应该增加,说明一定发生,固体分成两等份,在空气中充分灼烧后,所得固体为CuO,固体增重0.96 g,则参加反应的n(O)=0.06 mol,转移的电子数为0.12 mol,另一份与H2O2酸性溶液反应,得蓝色溶液,说明产物为Cu2+,转移电子数应与前一份相同为0.12 mol,H2O2被还原为H2O,1mol过氧化氢转移2mol电子,根据得失电子守恒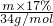 ×2=0.12 mol,则需17%H2O2的酸性溶液m=12.0g,
×2=0.12 mol,则需17%H2O2的酸性溶液m=12.0g,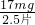 =6.8mg/片,
=6.8mg/片, 2CuO,结合得失电子守恒分析解答;
2CuO,结合得失电子守恒分析解答;

科目:高中化学 来源: 题型:
 (2010?梅州一模)过氧化钙是重要的工业原料,350℃时能迅速分解,生成氧化钙,并放出氧气.工业上将碳酸钙溶于适量的盐酸中,在低温和碱性条件下,与过氧化氢反应制得:CaCO3+2HCl═CaCl2+CO2↑+H2O,CaCl2+H2O2+2NH3+8H2O═CaO2?8H2O↓+2NH4Cl.如图是实验室测定产品中过氧化钙含量的装置.试回答下列问题:
(2010?梅州一模)过氧化钙是重要的工业原料,350℃时能迅速分解,生成氧化钙,并放出氧气.工业上将碳酸钙溶于适量的盐酸中,在低温和碱性条件下,与过氧化氢反应制得:CaCO3+2HCl═CaCl2+CO2↑+H2O,CaCl2+H2O2+2NH3+8H2O═CaO2?8H2O↓+2NH4Cl.如图是实验室测定产品中过氧化钙含量的装置.试回答下列问题:| 14.4(b-a) |
| mc |
| 14.4(b-a) |
| mc |
查看答案和解析>>
科目:高中化学 来源: 题型:
 过氧化钙是重要的工业原料,350℃时能迅速分解,生成氧化钙,并放出氧气.工业上将碳酸钙溶于适量的盐酸中,在低温和碱性条件下,与过氧化氢反应制得:CaCO3+2HCl═CaCl2+CO2↑+H2O,CaCl2+H2O2+2NH3+8H2O═CaO2?8H2O↓+2NH4Cl.如图是实验室测定产品中过氧化钙含量的装置.试回答下列问题:
过氧化钙是重要的工业原料,350℃时能迅速分解,生成氧化钙,并放出氧气.工业上将碳酸钙溶于适量的盐酸中,在低温和碱性条件下,与过氧化氢反应制得:CaCO3+2HCl═CaCl2+CO2↑+H2O,CaCl2+H2O2+2NH3+8H2O═CaO2?8H2O↓+2NH4Cl.如图是实验室测定产品中过氧化钙含量的装置.试回答下列问题:| 14.4(b-a) |
| mc |
| 14.4(b-a) |
| mc |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:江苏模拟题 题型:填空题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com