
 图中,A为空气中常见的气体单质,B、C、E是金属单质,D为非金属单质.已知:
图中,A为空气中常见的气体单质,B、C、E是金属单质,D为非金属单质.已知:| 高温 |
| 高温 |
| 高温 |
| 高温 |
| 高温 |
| ||
| ||
| ||
| ||


 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案科目:高中化学 来源: 题型:
| A、常温常压下,200g 8.5%的H2O2水溶液中含氧原子总数为nA |
| B、.标准状况下,22.4LCHCI3中含C-H键数目为nA |
| C、.常温下,14g丙烯(CH3CH=CH2)中含碳原子数为nA |
| D、.常温下,pH=13的氢氧化钠溶液中,含OH一数目为nA |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
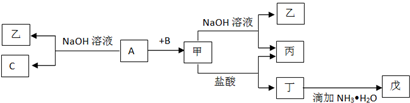
查看答案和解析>>
科目:高中化学 来源: 题型:

| 实验步骤 | 预期现象和结论 |
| 步骤4:取少量滤液于试管,往其中滴加2~3滴酚酞试液 | |
| 步骤5:另取少量滤液于另一试管,往其中滴加足量的 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.4mol?L-1 |
| B、0.2mol?L-1 |
| C、0.3mol?L-1 |
| D、0.6mol?L-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com