
【题目】氮的氢化物种类繁多,其中联氨(又称肼,N2H4,无色油状液体)是一种应用广泛的化工原料,可用作火箭燃料,回答下列问题:
(1)联氨分子的电子式为__________________,其中氮的化合价为 _________。
(2) ①2O2(g)+N2(g)=N2O4(l) △H1
②N2(g)+2H2(g)=N2H4(l) △H2
③O2(g)+2H2(g)=2H2O(g) △H3
④2 N2H4(l) + N2O4(l)= 3N2(g)+ 4H2O(g) △H4=-1048.9kJ/mol
上述反应热效应之间的关系式为△H4=____________________,联氨和N2O4可作为火箭推进剂的主要原因为_________________________________________。
(3)联氨是一种常用的还原剂。向装有少量AgBr的试管中加入联氨溶液,观察到的现象是固体逐渐变黑,并且有气泡产生,写出该反应的化学方程式__________________。
(4)联氨还可以用于处理高压锅炉水中的氧,防止锅炉被腐蚀。理论上1kg的联氨可除去水中溶解的O2_____kg;与使用Na2SO3处理水中溶解的O2相比,联氨的优点是__________。
【答案】![]() -2 2ΔH3 - ΔH1 - 2ΔH2 反应放热量大、产生大量气体 4AgBr+N2H4 = 4Ag+N2↑+ 4HBr 1 N2H4的用量少,且不产生其他杂质
-2 2ΔH3 - ΔH1 - 2ΔH2 反应放热量大、产生大量气体 4AgBr+N2H4 = 4Ag+N2↑+ 4HBr 1 N2H4的用量少,且不产生其他杂质
【解析】
(1)N2H4是氮原子和氢原子形成四个共价键,氮原子和氮原子间形成一个共价键形成的共价化合物,元素化合价代数和为0计算化合价;
(2)①2O2(g)+N2(g)=N2O4(l) △H1
②N2(g)+2H2(g)=N2H4(l) △H2
③O2(g)+2H2(g)=2H2O(g) △H3
根据热化学方程式和盖斯定律计算③×2-②×2-①得到④2N2H4(l) + N2O4(l)= 3N2(g)+ 4H2O(g) △H4=-1048.9kJ/mol;
(3)联胺被银离子氧化,银离子被还原生成单质银,-2价的N元素被氧化为N2;
(4)联胺被氧化失电子N2H4→N2失4e-,O2→O2-得到4e-,根据得失电子守恒计算;根据锅炉的质地以及反应产物性质解答。
(1)肼的分子式为N2H4,是氮原子和氢原子形成四个共价键,氮原子和氮原子之间形成一个共价键形成的共价化合物,电子式为: ![]() ,其中氢元素化合价为+1价,则氮元素化合价为-2价,
,其中氢元素化合价为+1价,则氮元素化合价为-2价,
因此,本题正确答案是: ![]() ;-2;
;-2;
(2) ①2O2(g)+N2(g)=N2O4(l) △H1
②N2(g)+2H2(g)=N2H4(l) △H2
③O2(g)+2H2(g)=2H2O(g) △H3
根据热化学方程式和盖斯定律计算③×2-②×2-①得到④2N2H4(l) + N2O4(l)= 3N2(g)+ 4H2O(g) △H4=2ΔH3 - ΔH1 - 2ΔH2,
根据反应④可以知道,联氨和N2O4反应放出大量热且产生大量气体,因此可作为火箭推进剂,
因此,本题正确答案是:2ΔH3 - ΔH1 - 2ΔH2;反应放热量大,产生大量气体;
(3)联胺被银离子氧化,银离子被还原生成单质银,-2价的N元素被氧化为N2,反应方程式为:4AgBr+N2H4 = 4Ag+N2↑+ 4HBr,
因此,本题正确答案是:4AgBr+N2H4 = 4Ag+N2↑+ 4HBr;
(4)联胺被氧化失电子N2H4→N2失4e-,O2→O2-得到4e-,联胺和氧气摩尔质量都是32g/mol,则等质量联胺和氧气物质的量相同,理论上1kg的联氨可除去水中溶解的O21kg;
因为肼的氧化产物是氮气,不会对锅炉造成腐蚀,而亚硫酸钠被氧化产物为硫酸钠,易生成硫酸盐沉淀影响锅炉的安全使用,与使用Na2SO3处理水中溶解的O2相比,联氨的优点是用量少,不产生其他杂质(反应产物为N2和H2O,而Na2SO3产生Na2SO4,
因此,本题正确答案是:1;N2H4的用量少,且不产生其他杂质。


科目:高中化学 来源: 题型:
【题目】青蒿素是最好的抵抗疟疾的药物,可从黄花蒿茎叶中提取,它是无色针状晶体,可溶于乙醇、乙醚等有机溶剂,难溶于水。常见的提取方法如下。

(1)操作I、II中,不会用到的装置是________(填序号)。

(2)向干燥、破碎后的黄花蒿中加入乙醚的作用是________。
(3)操作III的目的是_________。
(4)某同学发现青蒿素可以使湿润的淀粉碘化钾试纸变蓝,依据此现象在其键线式上圈出对应的基团_________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向300mL2.0 mol/L盐酸中加入几小块大理石,产生气体的体积随时间的变化曲线如右图所示(气体体积在标准状况下测定)试回答下列问题:

(1)若以反应中消耗的HCl表示反应速率,设OE段的反应速率为v1,EF段的反应速率为v2,FG段的反应速率为v3,则v1、v2、v3从大到小的顺序为_______,其中造成v1和v2大小关系的主要原因是__________。
(2)为了减缓上述反应的速率,欲向该溶液中加入下列物质,你认为可行的是_____(填编号)
A.浓硫酸 B.Na2CO3 C.蒸馏水 D.浓盐酸
(3)若反应过程中溶液体积的变化忽略不计,用盐酸表示的化学反应速率v(HCl)=________mol/(Lmin)。.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.可用澄清石灰水鉴别二氧化硫和二氧化碳
B.将二氧化硫通入氯化钡溶液中无明显现象,不断振荡,溶液变浑浊
C.工业上或实验室用亚硫酸钠固体与稀硫酸反应制备二氧化硫
D.二氧化硫能使含酚酞的氢氧化钠溶液褪色,体现了其漂白性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通过以下反应可获得新型能源二甲醚(CH3OCH3)。下列说法不正确的是
①C(s) + H2O(g)==CO(g)+H2(g) ΔH1=a kJmol-1
②CO(g) + H2O(g)==CO2(g)+H2(g) ΔH2=b kJmol-1
③CO2(g)+3H2(g)==CH3OH(g)+H2O(g) ΔH3 =c kJmol-1
④2CH3OH(g) ==CH3OCH3(g)+H2O(g) ΔH4=d kJmol-1
A. 反应①②为反应③提供原料气
B. 反应③也是CO2资源化利用的方法之一
C. 反应CH3OH(g)== ![]() CH3OCH3(g)+
CH3OCH3(g)+ ![]() H2O(1)的ΔH =
H2O(1)的ΔH =![]() kJmol-1
kJmol-1
D. 反应 2CO(g)+4H2(g) ==CH3OCH3(g)+H2O(g)的ΔH= (2b+2c+d) kJmol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验不能获得成功的是
①将醋酸钠晶体与碱石灰混合加热来制取甲烷;
②将乙醇与浓硫酸共热至140°C来制取乙烯;
③在电石中加水制取乙炔;
④苯、浓溴水和铁粉混和,反应后可制得溴苯;
A.只有②B.只有①②C.只有①②④D.只有②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】依据氧化还原反应:Zn(s)+Cu2+(aq)===Zn2+(aq)+Cu(s)设计的原电池如下图所示。
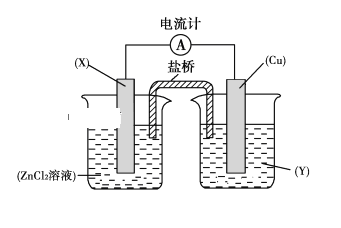
请回答下列问题:
(1)电极X的材料是________;电解质溶液Y是________。
(2)铜电极为电池的________极,发生的电极反应为______________________,X极上发生的电极反应为________________。
(3)外电路中的电子是从________极流向________极。
(4)盐桥中的Cl-向________极移动,如将盐桥撤掉,电流计的指针将________偏转。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化钠能与二氧化碳反应,在“神七”的航天舱中、在宇航员太空漫步时穿的航天服中、在潜艇中均使用过氧化钠作制氧剂,供人呼吸之用。某学生选用大理石、盐酸和一定量过氧化钠药品设计实验,验证这一事实。
请根据所给装置回答下列问题:

(1)A是制取CO2的装置,最好选用下列装置中的______________ (填序号)。

(2)B装置中发生的离子方程式是_______________________。C装置的作用是_______________________。
(3)D装置中发生反应的化学方程式是_________________。
(4)要想得到较纯净的氧气,可在装置D和E之间增加一盛有________(填写试剂名称)的________(填写装置名称)。
(5)如何检验集气瓶中收集到的气体______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了验证Fe3+的性质,某化学兴趣小组设计了下图所示的一组实验,其中实验方案设计错误的是( )

A. 只有④ B. 只有③
C. ③和④均错误 D. 全部错误
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com