
有A、B、C、D、E、F六种元素,已知:
①它们位于三个不同短周期,核电荷数依次增大。
②E元素的电离能数据见下表(kJ·mol-1):
| I1 | I2 | I3 | I4 | … |
| 496 | 4 562 | 6 912 | 9 540 | … |
③B与F同主族。
④A、E分别都能与D按原子个数比1∶1或2∶1形成化合物。
⑤B、C分别都能与D按原子个数比1∶1或1∶2形成化合物。
(1)写出只含有A、B、D、E四种元素的两种无水盐的化学式______________、______________。
(2)B2A2分子中存在_________个σ键,_________个π键。
 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案科目:高中化学 来源: 题型:
有下列八种不饱和烃:
A:CH2===CH—CH===CH2
B: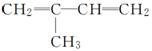
C:CH2===CH—CH===CH—CH3
D:
E:
F:CH≡CH
G:CH3—C≡CH
H:CH3—C≡C—CH3
(1)已知A+F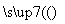
 ,若要合成
,若要合成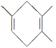 ,则下列所选原料正确的是________(填序号)。
,则下列所选原料正确的是________(填序号)。
①D和H ②E和H ③E和F ④B和H ⑤C和H
⑥D和G
(2)B和Br2的CCl4溶液发生反应时,可生成多种产物,写出这些产物的结构简式:______________________,____________________,________________________,__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室模拟用工业废弃固体(含有Cu2S、Al2O3、Fe2O3、SiO2等)制取粗铜、绿矾(FeSO4·7H2O)和明矾[KAl(SO4)2·12H2O]的操作流程如下:
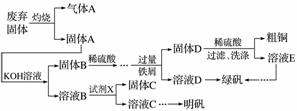
(1)试剂X是________(写化学式)。
(2)配平下列方程式:
MnO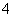 +____SO2+____H2O===____Mn2++____SO
+____SO2+____H2O===____Mn2++____SO +____H+
+____H+
(3)为了分析产品(绿矾)中铁元素的含量,某同学称取20.0 g 样品配成100 mL溶液,移取25.00 mL于锥形瓶中,用1.000×10-1 mol·L-1的KMnO4标准溶液进行滴定(MnO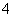 被还原为Mn2+)。
被还原为Mn2+)。
请回答下列问题:
①滴定时,KMnO4标准溶液应盛放在______________(填仪器名称)中。
②若到达滴定终点消耗KMnO4标准溶液的体积为25.00 mL,则该产品中铁元素的质量分数为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
某些化学键的键能如下表(单位kJ·mol-1),据此,回答下列问题:
| 键 | H—H | Br—Br | I—I | Cl—Cl | H—Cl | H—I | H—Br |
| 键能 | 436 | 193 | 151 | 247 | 431 | 299 | 356 |
(1)1 mol H2在2 mol Cl2中燃烧,放出的热量为____kJ。
(2)在一定条件下,1 mol H2与足量的Cl2、Br2、I2分别反应,放出热量由多到少的顺序是________。
a.Cl2>Br2>I2 b.I2>Br2>Cl2
预测1 mol H2在足量F2中燃烧比在Cl2中放热______。
查看答案和解析>>
科目:高中化学 来源: 题型:
化学反应可视为旧键断裂和新键形成的过程。化学键的键能是形成(或拆开)1 mol化学键时释放(或吸收)的能量。已知白磷和P4O6的分子结构如下图所示 。现提供以下化学键的键能数据(kJ·mol-1):P—P:198,P—O:360,O===O:497.3。
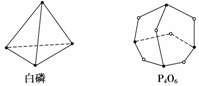
反应:P4(白磷)+3O2===P4O6的能量变化为( )
A.释放1 640.1 kJ的能量
B.吸收1 640.1 kJ的能量
C.释放126.3 kJ的能量
D.吸收126.3 kJ的能量
查看答案和解析>>
科目:高中化学 来源: 题型:
某样品是由碳酸钠与氯化钠组成的固体混合物,现欲测定样品中碳酸钠的质量分数。
某同学称取10.00 g样品,配成1 000 mL溶液,用______(填仪器名称)量取25.00 mL放入锥形瓶中,加入甲基橙作指示剂,用0.150 0 mol·L-1标准盐酸溶液滴定至终点,平行测定三次,有关实验数据记录如下表,则样品中碳酸钠的质量分数为__________。
| 实验编号 | 待测液体积(mL) | 标准液体积(mL) | |
| 滴定前读数 | 终点时读数 | ||
| 1 | 25.00 | 0.00 | 30.02 |
| 2 | 25.00 | 0.20 | 33.80 |
| 3 | 25.00 | 1.40 | 31.38 |
查看答案和解析>>
科目:高中化学 来源: 题型:
通过沉淀-氧化法处理含铬废水,减少废液排放对环境的污染,同时回收K2Cr2O7。实验室对含铬废液(含有Cr3+、Fe3+、K+、SO 、NO
、NO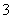 和少量Cr2O
和少量Cr2O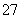 )回收与再利用工艺如下:
)回收与再利用工艺如下:

已知:①Cr(OH)3+OH-===CrO +2H2O;
+2H2O;
②2CrO +3H2O2+2OH-===2CrO
+3H2O2+2OH-===2CrO +4H2O;
+4H2O;
③H2O2在酸性条件下具有还原性,能将+6价Cr还原为+3价Cr。
(1)实验中所用KOH浓度为6 mol·L-1,现用KOH固体配制250 mL 6 mol·L-1的KOH溶液,除烧杯、玻璃棒外,还必需用到的玻璃仪器有________。
(2)滤液Ⅰ酸化前,进行加热的目的是________。冰浴、过滤后,应用少量冷水洗涤K2Cr2O7,其目的是________________________。
(3)下表是相关物质的溶解度数据:
| 物质 | 0 ℃ | 20 ℃ | 40 ℃ | 60 ℃ | 80 ℃ | 100 ℃ |
| KCl | 28.0 | 34.2 | 40.1 | 45.8 | 51.3 | 56.3 |
| K2SO4 | 7.4 | 11.1 | 14.8 | 18.2 | 21.4 | 24.1 |
| K2Cr2O7 | 4.7 | 12.3 | 26.3 | 45.6 | 73.0 | 102.0 |
| KNO3 | 13.9 | 31.6 | 61.3 | 106 | 167 | 246.0 |
根据溶解度数据,操作Ⅰ具体操作步骤为①__________________、②__________。
(4)称取产品重铬酸钾试样2.000 g配成250 mL溶液,取出25.00 mL于锥形瓶中,加入10 mL 2 mol·L-1 H2SO4和足量碘化钠(铬的还原产物为Cr3+),放于暗处5 min,然后加入100 mL水,加入3 mL淀粉指示剂,用0.120 0 mol·L-1 Na2S2O3标准溶液滴定(I2+2S2O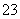 ===2I-+S4O
===2I-+S4O )。
)。
①若实验中共用去Na2S2O3标准溶液30.00 mL,所得产品中重铬酸钾的纯度为________(设整个过程中其他杂质不参与反应)。
②若滴定管在使用前未用Na2S2O3标准溶液润洗,测得的重铬酸钾的纯度将________(填“偏高”、“偏低”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
将两个铂电极插入500 mL CuSO4溶液中进行电解,通电一定时间后,某一电极增重0.064 g(设电解时该电极无氢气析出,且不考虑水解和溶液体积变化),此时溶液中氢离子浓度约为( )
A.4×10-3 mol·L-1 B.2×10-3 mol·L-1
C.1×10-3 mol·L-1 D.1×10-7 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
依据反应事实书写热化学方程式
依据事实,写出下列反应的热化学方程式。
(1)SiH4是一种无色气体,遇到空气能发生爆炸性自燃,生成SiO2和液态H2O。已知室温下2 g SiH4自燃放出热量89.2 kJ。SiH4自燃的热化学方程式为________________________________________________________________________
________________________________________________________________________。
(2)在25 ℃、101 kPa下,一定质量的无水乙醇完全燃烧时放出热量Q kJ,其燃烧生成的CO2用过量饱和石灰水吸收可得100 g CaCO3沉淀,则乙醇燃烧的热化学方程式为________________________________________________________________________
________________________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com