
实验室中以下物质的贮存方法,不正确的是
A.保存硫酸亚铁溶液时,向其中加入铁钉和少量硫酸
B.少量金属钠保存在煤油中
C.少量液溴可用水封存,防止溴挥发
D.浓硝酸用带橡胶塞的细口、棕色试剂瓶盛放,并贮存在阴凉处
D
【解析】
试题分析:A.硫酸亚铁是强酸弱碱盐,水解使溶液显酸性,为了抑制盐的水解要加入少量硫酸;而Fe2+有还原性,容易被空气中的氧气氧化为Fe3+,为了防止盐的氧化变质,所以保存硫酸亚铁溶液时,还要加入还原剂铁钉,正确;B.由于Na容易与空气中的氧气、和水发生反应,所以Na要密封保存,因为Na与煤油不反应而且煤油的密度比Na小,因此可以保存计算Na,正确;C.液溴容易挥发,为了防止溴挥发,少量液溴可用水封存,正确;D.浓硝酸不稳定,受热或光照容易分解,因此要保存棕色试剂瓶盛放,并贮存在阴凉处,而且有强的腐蚀性,容易腐蚀橡胶,故要用带玻璃塞的细口瓶中,错误。
考点:考查实验室中物质的贮存方法的知识。


科目:高中化学 来源:2015届山东省聊城市高三上学期第一次阶段性测试化学试卷(解析版) 题型:选择题
除去下列物质中所含的杂质(括号内为杂质),选用试剂正确的是( )
A.Al2O3(SiO2):NaOH溶液
B.CO2(SO2):Na2CO3溶液
C.FeCl2溶液(FeCl3):Fe粉
D.NaHCO3溶液(Na2CO3溶液):Ca(OH)2溶液
查看答案和解析>>
科目:高中化学 来源:2015届山东省潍坊市高三上学期期中考试化学试卷(解析版) 题型:选择题
反应①、②分别是从海藻灰和某种矿石中提取碘的主要反应:
①2NaI+MnO2+3H2SO4═2NaHSO4+MnSO4+2H2O+I2
②2NaIO3+5NaHSO3═2Na2SO4+3NaHSO4+H2O+I2
下列说法正确的是( )
A.两个反应中均为硫元素被氧化
B.碘元素在反应①中被还原,在反应②中被氧化
C.氧化性:MnO2>SO42->IO3->I2
D.反应①、②中生成等量的I2时转移电子数比为1:5
查看答案和解析>>
科目:高中化学 来源:2015届山东省潍坊市诸城高三10月月考化学试卷(解析版) 题型:选择题
海洋中有丰富的食品、矿产、能源和药物。下图是从海水中提取某些原料的流程图。
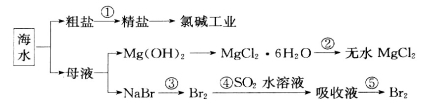
下列有关说法正确的是
A.从海水中提取物质都必须通过化学反应才能实现
B.第②步属于物理变化
C.从第④~⑤步的目的是浓缩、富集溴单质
D.第①步中除去粗盐中的SO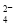 、Ca2+、Mg2+、Fe3+等杂质,加入试剂的顺序为:Na2CO3溶液→NaOH溶液→BaCl2溶液→过滤后加盐酸
、Ca2+、Mg2+、Fe3+等杂质,加入试剂的顺序为:Na2CO3溶液→NaOH溶液→BaCl2溶液→过滤后加盐酸
第Ⅱ卷(非选择题,共55分)
查看答案和解析>>
科目:高中化学 来源:2015届山东省潍坊市诸城高三10月月考化学试卷(解析版) 题型:选择题
下列说法正确的是
A.阳离子只有氧化性,阴离子只有还原性
B.失电子难的原子获得电子的能力一定强
C.得到电子越多的氧化剂,其氧化性就越强
D.要实现Fe2+→Fe3+的转化,必须加入氧化剂
查看答案和解析>>
科目:高中化学 来源:2015届山东省高三10月阶段性考试化学试卷(解析版) 题型:填空题
(12分)某化学兴趣小组采用下列方法测定Na2SO3样品中Na2SO4的质量分数。
【方法一】测 SO2质量法
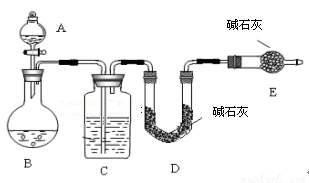
采用如图所示装置,通过实验测定生成SO2的质量。
(1)C中盛放的试剂是 ,E装置的作用是 。
(2)若实验前称取m1g样品,再测得SO2的质量为m2g,则可得Na2SO4质量分数,其中m2是通过测定 (填装置符号)装置在实验前后的质量差得到的。该方法的缺点是(只答一点)
。
【方法二】测沉淀质量法
第一步:称取m3g样品,置于小烧杯中 第二步:向小烧杯中加入足量稀盐酸,加热
第三步:再向小烧杯中加入足量BaCl2溶液,然后过滤、洗涤 第四步:干燥沉淀,称重为m4g
(3)简述洗涤沉淀的方法: 。
(4)若m3=2m4 则试样中Na2SO4的质量分数为 。
查看答案和解析>>
科目:高中化学 来源:2015届山东省高三10月阶段性考试化学试卷(解析版) 题型:选择题
海洋中有丰富的食品、矿产、能源、药物和水产资源,下图为海水利用的部分过程。下列有关说法正确的是( )
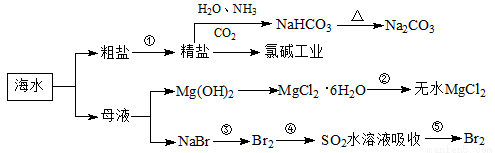
A.制取NaHCO3的反应是利用其溶解度小于NaCl
B.用澄清的石灰水可鉴别NaHCO3和Na2CO3
C.在第③、④、⑤步骤中,溴元素均被氧化
D.工业上通过电解饱和MgCl2溶液制取金属镁
查看答案和解析>>
科目:高中化学 来源:2015届山东省济宁市高三10月阶段测试化学试卷(解析版) 题型:实验题
(10分)某校化学实验兴趣小组在“探究卤素单质的氧化性”的系列实验中发现:在足量的稀氯化亚铁溶液中,加入1~2滴溴水,振荡后溶液呈黄色。
(1)提出问题:Fe3+、Br2哪一个的氧化性更强?
(2)猜想
①甲同学认为氧化性:Fe3+>Br2,故上述实验现象不是发生化学反应所致,则溶液呈黄色是含
(填化学式,下同)所致。
②乙同学认为氧化性:Br2>Fe3+,故上述实验现象是发生化学反应所致,则溶液呈黄色是含___所致。
3)设计实验并验证
丙同学为验证乙同学的观点,选用下列某些试剂设计出两种方案进行实验,并通过观察实验现象,证明了乙同学的观点确实是正确的。供选用的试剂:
A.酚酞试液 B.CCl4 C.无水酒精 D.KSCN溶液
请你在下列表格中写出丙同学选用的试剂及实验中观察到的现象。(试剂填序号)
| 选用试剂 | 实验现象 |
方案1 |
|
|
方案2 |
|
|
(4)应用与拓展
①在足量的稀氯化亚铁溶液中加入l~2滴溴水,溶液呈黄色,所发生的离子反应方程式为
____________________________。
②在FeBr2溶液中通入足量 Cl2,所发生的离子反应方程式为 。
查看答案和解析>>
科目:高中化学 来源:2015届山东省泰安市高三上学期期中考试化学试卷(解析版) 题型:选择题
下列实验现象预测正确的是
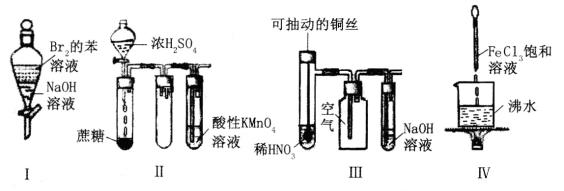
A.实验I:振荡后静置,上层溶液颜色保持不变
B.实验Ⅱ:酸性KMnO4溶液中无明显现象
C.实验III:微热稀HNO3片刻,溶液中有气泡产生,广口瓶内始终保持无色
D.实验Ⅳ:继续煮沸溶液至红褐色,停止加热,当光束通过体系时可产生丁达尔效应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com