
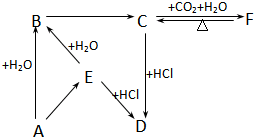
 根据要求回答相关问题:
根据要求回答相关问题:
| ||
| ||
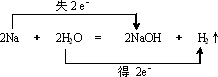 ,
, ;
;

 轻松暑假总复习系列答案
轻松暑假总复习系列答案科目:高中化学 来源: 题型:
| A、可以根据PbI2和AgCl的Ksp的大小比较两者的溶解能力 |
| B、常温下,同浓度的Na2S与NaHS溶液相比,NaHS溶液的pH大 |
| C、等物质的量浓度的NH4Cl溶液和NH4HSO4溶液,后者的c(NH4+)大 |
| D、能使碘化钾淀粉试纸变蓝的溶液中,Na+、S2-、Br-、NH4+等离子可以大量共存 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)在一体积为10L的容器中,通人一定量的CO和H2O,在850℃时发生如下反应:
(1)在一体积为10L的容器中,通人一定量的CO和H2O,在850℃时发生如下反应:| 时间/min | CO | H2O | CO2 | H2 |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | C1 | c2 | c3 | c3 |
| 4 | C1 | c2 | c3 | c3 |
| 5 | 0.116 | 0.216 | 0.084 | |
| 6 | 0.096 | 0.266 | 0.104 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
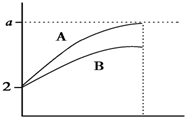 pH=2的两种酸溶液A、B各1mL,分别加水稀释到100mL,其pH与溶液体积(V)的关系如图示,下列说法不正确的是( )
pH=2的两种酸溶液A、B各1mL,分别加水稀释到100mL,其pH与溶液体积(V)的关系如图示,下列说法不正确的是( )| A、稀释过程中,c(H+)不断减少、c(OH-)不断增多 |
| B、稀释后,A酸溶液的酸性比B酸溶液弱 |
| C、若a=4,则A是强酸,B是弱酸 |
| D、A、B两种酸溶液的物质的量浓度一定相等 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com