
按下列要求完成各小题:
(1)Na2O2的电子式 ,该化合物属于 化合物;
(2)H2O分子的结构式;
(3)NH3分子的空间构型是 ;
(4)CO2分子的球棍模型 (注意原子半径的大小);
(5)非金属性最强的元素与原子半径最小的元素形成的化合物的电子式 .
| 电子式;球棍模型与比例模型;判断简单分子或离子的构型. | |
| 专题: | 化学用语专题. |
| 分析: | (1)过氧化钠是有2个钠离子与过氧根离子通过离子键构成,两个氧原子间通过共用电子对结合; (2)水分子是由两个氢原子与氧原子通过共用电子对构成; (3)根据价层电子对互斥理论确定分子空间构型; (4)CO2分子中碳原子最外层有4个电子,形成4个共价键;氧原子最外层有6个电子,形成2个共价键,为直线型结构; (5)非金属性最强的元素为F,原子半径最小的元素为H,二者共用1对电子结合在一起. |
| 解答: | 解:(1)Na2O2是钠离子和过氧根离子构成的离子化合物,钠离子失电子形成阳离子,氧原子得到电子形成过氧根阴离子,电子式为 故答案为: (2)H2O分子中有2对共用电子对,则H2S结构式H﹣O﹣H,故答案为:H﹣O﹣H; (3)NH3分子中氮原子含有3个共价键和一个孤电子对,所以空间构型是三角锥型,故答案为:三角锥型; (4)二氧化碳存在2个C=O,是直线型结构:球棍模型: (5)氟化氢的电子式: |
| 点评: | 本题考查了化学用语,根据结构简式、电子式的书写规则书写即可,注意离子化合物和共价化合物电子式的书写区别,题目难度不大. |


 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案科目:高中化学 来源: 题型:
科学家最近发现两种粒子:第一种是只由四个中子构成的粒子,这种粒子称为“四中子”也有人称之为“零号元素”,第二种是由四个氧原子构成的分子,下列有关这两种粒子的说法不正确的是 ( )
A.“四中子”不显电性 B.“四中子”的质量数为4,其质量比氢原子大
C.第二种粒子是氧元素的另一种同位素
D.第二种粒子的化学式为O4 ,与O2互为同素异形体
查看答案和解析>>
科目:高中化学 来源: 题型:
有下列几组物质,请将序号填入下列空格内:
①CH2=CH﹣COOH和油酸(C17H33COOH) ②12C60和石墨 ③35Cl和37Cl ④乙醇和乙二醇
⑤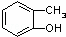 和
和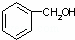 ⑥
⑥ 和
和
(1)互为同位素的是 ;
(2)互为同系物的是 ;
(3)互为同素异形体的是 ;
(4)互为同分异构体的是 ;
(5)既不是同系物,又不是同分异构体,但可看成是同一类物质的是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于1﹣20号元素的原子结构的有关说法正确的( )
|
| A. | 离子的最外层电子数比其次外层电子数多的元素一定是第二周期的元素 |
|
| B. | 元素形成的简单离子中,最外层电子数一定是8或2 |
|
| C. | 最外层电子数与次外层电子数相等的离子一定是第三周期的非金属元素 |
|
| D. | 原子得到电子成为阴离子时,电子层数一定不变,原子失去电子成为阳离子时,电子层数一定减少 |
查看答案和解析>>
科目:高中化学 来源: 题型:
甲、乙两容器中均进行反应:N2+3H2⇌2NH3,在相同时间内,甲容器中断裂1molN≡N键且同时形成3molH﹣H键,乙容器中断裂0.5molN≡N键且同时断裂3molN﹣H键,下列说法正确的是( )
|
| A. | 甲容器中的反应速率一定大于乙容器中的反应速率 |
|
| B. | 甲容器中的反应速率可能小于乙容器中的反应速率 |
|
| C. | 无法判断两容器中的上述反应是否都达到了平衡状态 |
|
| D. | 上述两容器中的反应一定是在相同温度和相同压强下进行的 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于元素及其化合物的说法正确的是
A.Fe在常温下可与浓硝酸、稀硝酸、浓硫酸发生剧烈的反应
B.NaHCO3可用于制备纯碱、治疗胃酸过多的药剂、食品发酵剂
C.通过丁达尔效应可以鉴别稀豆浆和Fe(OH)3胶体
D.根据某元素原子的质子数和中子数,可以确定该元素的相对原子质量
查看答案和解析>>
科目:高中化学 来源: 题型:
Ⅰ.实验室常见的几种气体发生装置如图A、B、C所示:
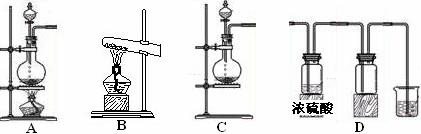
(1) 实验室可以用B或C装置制取氨气,如果用B装置制取氨气其化学反应方程式为
。
(2)气体的性质是选择气体收集方法的主要依据。下列性质与收集方法无关的是
_____________(填序号,下同)。
①密度 ②颜色 ③溶解性 ④热稳定性 ⑤与氧气反应
(3)若用A装置与D装置相连制取并收集X气体,则X可以是下列气体中的________。
①CO2 ②NO ③Cl2 ④H2 ⑤HCl
其中在D装置中连接小烧杯的目的是 。
Ⅱ.某小组以CoCl2·6H2O、NH4Cl、H2O2、浓氨水为原料,在活性炭催化下,合成了橙黄色晶体X。为确定其组成,进行如下实验 。
(4)经测定,样品X中钴、氨和氯的物质的量之比为1∶6∶3 ,钴的化合价为________,制备X的化学方程式为
已知:X的化学式类似下列化学式
氢氧化二氨合银:Ag(NH3)2OH 、硫酸四氨合铜:Cu(NH3)4SO4
(5)氨的测定:精确称取w g X,加适量水溶解,注入如图所示的三颈瓶中,然后逐滴加入足量10% NaOH溶液,通入水蒸气,将样品液中的氨全部蒸出,用V1 mL cl mol·L-1 的盐酸标准溶液吸收。蒸氨结束后取下接收瓶,用c2 mol·L-1 NaOH标准溶液滴定过剩的HCl,到终点时消耗V2 mL NaOH溶液。
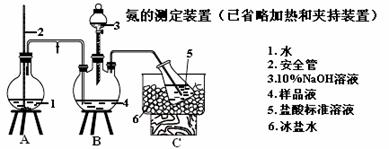
①盛放5(盐酸标准溶液)的仪器名称
②装置中安全管的作用原理是
③样品中氨的质量分数表达式为
查看答案和解析>>
科目:高中化学 来源: 题型:
粉末状试样A是由等物质的量的MgO和Fe2O3组成的混合物。进行如下实验:
①取适量A进行铝热反应,产物中有单质B生成;
②另取20 g A全部溶于0.15 L 6.0 mol·L-1盐酸中,得溶液C;
③将①中得到的单质B和溶液C反应,放出1.12 L(标准状况)气体,同时生成溶液D,还残留有固体物质B;
④用KSCN溶液检验时,溶液D不变色。
请填空:
(1)①引发铝热反应的实验操作是 ,
产物中单质B是 。
(2)②中所发生的各反应的化学方程式为
、
。
(3)③中所发生的各反应的离子方程式为
、
。
(4)若溶液D的体积仍视为0.15 L,则该溶液中c(Mg2+)为 ,c(Fe2+)为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
在智利硝石矿层中含有碘酸钠,可用亚硫酸氢钠与其反应来制备单质碘,其化学方程式是:2NaIO3+5NaHSO3=3NaHSO4+2NaSO4+I2+H2O
(1)反应中 元素被氧化, 是氧化剂.
(2)反应产物中,氧化产物与还原产物的物质的量之比为 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com