
焰火表演,精彩纷呈,有着浓厚的地方特色,让人惊叹不已。下列关于焰色反应的说法正确的是
A.每次焰色反应实验前,铂丝要先用硫酸洗涤
B.用固体样品或配成相应的溶液进行焰色反应,现象相同
C.焰色反应均应透过蓝色钴玻璃观察
D.非金属单质燃烧时火焰均为无色
 名师金手指领衔课时系列答案
名师金手指领衔课时系列答案科目:高中化学 来源:2017届西藏山南二中高三上11月月考化学试卷(解析版) 题型:选择题
19世纪中叶,门捷列夫的突出贡献是( )
A. 提出原子学说 B. 发现元素周期律 C. 提出分子学说 D. 发现氧气
查看答案和解析>>
科目:高中化学 来源:2017届湖南省长沙市高三上月考四化学卷(解析版) 题型:选择题
原子结构决定元素的性质,下列说法中,正确的是
A. Na、Al、Cl的原子半径依次减小,Na+、Al3+、C1-的离子半径也依次减小
B. 在第VIA族元素的氢化物(H2R)中,热稳定性最强的其沸点也最高
C. 第2周期元素的最高正化合价都等于其原子的最外层电子数
D. 非金属元素的非金属性越强,其氧化物对应水化物的酸性也一定越强
查看答案和解析>>
科目:高中化学 来源:2016-2017学年浙江省高一上期中化学卷(解析版) 题型:选择题
工业上制取ClO2的化学反应:2NaClO3+SO2+H2SO4=2ClO2+2NaHSO4,下列说法正确的是
A.SO2在反应中被还原 B.NaClO3在反应中失去电子
C.H2SO4在反应中作氧化剂 D.1 mo l氧化剂在反应中得到1 mol电子
l氧化剂在反应中得到1 mol电子
查看答案和解析>>
科目:高中化学 来源:2016-2017学年浙江省高一上期中化学卷(解析版) 题型:选择题
下列关于漂白粉的叙述正确的是
A.漂白粉的有效成分是Ca(ClO)2和CaCl2 B.漂白粉在空气中久置后会变质
C.漂白粉是由Cl2与烧碱制得的 D.在使用漂白粉时应用浓盐 酸
酸
查看答案和解析>>
科目:高中化学 来源:2016-2017学年浙江省高一上期中化学卷(解析版) 题型:选择题
在反应中,元素X的原子将电子转移给元素Y的原子,则下列说法正确的是
①元素X被氧化 ②元素Y被氧化 ③元素X发生还原反应 ④元素Y发生还原反应
A.①④ B.③④ C.②③ D.①②
查看答案和解析>>
科目:高中化学 来源:2016-2017学年云南省高二上期中化学卷(解析版) 题型:选择题
尿黑酸症是由酪氨酸在人体内非正常代谢而产生的一种遗传病。其转化过程如下:
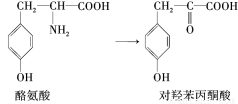
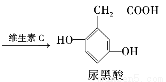
下列说法错误的是 ( )
A.酪氨酸既能与盐酸反应,又能与NaOH溶液反应
B.对羟苯丙酮酸分子中有3种含氧官能团
C.1 mol尿黑酸最多可与含3 mol NaOH的溶液反应
D.可用溴水鉴别对羟苯丙酮酸与尿黑酸
查看答案和解析>>
科目:高中化学 来源:2016-2017学年安徽省高二上阶段测二化学卷(解析版) 题型:实验题
浅绿色的硫酸亚铁铵晶体[又名莫尔盐,(NH4)2SO4·FeSO4·6H2O]比绿矾(FeSO4﹒7H2O)更稳定,常用于定量分析。莫尔盐的一种实验室制法如下:
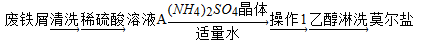
(1)向废铁屑中加入稀硫酸后,并不等铁屑完全溶解而是剩余少量时就进行过滤,其目的是________。
(2)0.10mol·L-1莫尔盐溶液中离子浓度由大到小的顺序为_________;
(3)常温下,若0.1 mol﹒L-1 (NH4)2SO4溶液的pH=5,求算NH3﹒H2O的电离平衡常数Kb=___________
(4)为了测定产品的纯度,称取ag产品溶于水,配制成500mL溶液,用浓度为c mol﹒L-1的酸性KMnO4溶液滴定。每次所取待测液体积均为25.00mL,实验结果记录如下:
实验次数. | 第一次 | 第二次 | 第三次 |
消耗高锰酸钾溶液体积/mL | .25.52, | 25.02 | 24.98 |
滴定过程中发生反应的离子方程式为:_______________。滴定终点的现象是____________________。
通过实验数据计算的该产品纯度为_________(用字母ac表)。上表中第一次实验中记录数据明显大于后两次,其原因可能是____________(填符号)。
A.实验结束时俯视刻度线读取滴定终点时酸性高锰酸钾溶液的体积
B.滴定前滴定管尖嘴有气泡,滴定结束无气泡
C.第一次滴定用的锥形瓶用待装液润洗过,后两次未润洗
C.第一次滴定用的锥形瓶用待装液润洗过,后两次未润洗
D.该酸性高锰酸钾标准液保存时间过长,有部分变质,浓度降低
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖北省襄阳市四校高一上学期期中化学试卷(解析版) 题型:填空题
已知铜和浓硫酸可以在加热条件下发生反应,化学方程式如下(已配平):
Cu+2H2SO4(浓) CuSO4+A↑+2H2O
CuSO4+A↑+2H2O
试通过计算和推理完成下面的问题:
(1)A物质可以与强碱反应生成盐和水,则A应该属于 (用字母代号填写)。
a.酸 b.碱 c.盐 d. 酸性氧化物 e.碱性氧化物
酸性氧化物 e.碱性氧化物
(2)该反应中被还原的元素是 (填元素名称);氧化产物是 (填化学式)
 。
。
(3)若反应消耗了3.2g Cu,则转移电子数 ,被还原的硫酸物质的量为 mol。
(4)将(2)中反应后所得到的溶液稀释后与足量BaCl2溶液反应,写出此过程发生反应的离子方程式  。
。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com