
下列说法正确的是( )
A.戊烷、戊醇、戊烯、乙酸乙酯中同分异构体数目最少的是戊烯
B.分子式为C4H9Cl的有机化合物有4种
C.丙烯与HCl在一定条件下的产物只有一种
D.用CH2(NH2)-COOH和CH3-CH(NH2)-COOH两种氨基酸脱水,最多可以生成3种2肽
 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源:2015-2016学年陕西西安长安一中高二下第二次月考化学卷(解析版) 题型:选择题
已知如下反应:
 在水溶液中存在平衡:
在水溶液中存在平衡: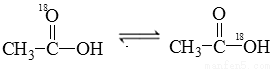 当
当 与 CH3CH2OH发生酯化反应时,不可能生成的产物是( )
与 CH3CH2OH发生酯化反应时,不可能生成的产物是( )
A. B.
B.
C. H2O  D. H218O
D. H218O
查看答案和解析>>
科目:高中化学 来源:2016届海南省高三全真模拟二化学试卷(解析版) 题型:填空题
I.下列说法中正确的是 。
A.丙烯分子中有8个σ键,1个π键
B.在SiO2晶体中,1个Si原子和2个O原子形成2个共价键
C.NF3的沸点比NH3的沸点低得多,是因为NH3分子间有氢键,NF3只有范德华力
D.NCl3和BC13分子中,中心原子都采用sp3杂化
II.人类在使用金属的历史进程中,经历了铜、铁、铝之后,第四种将被广泛应用的金属被科学家预测是钛(Ti),它被誉为“未来世纪的金属”。试回答下列问题:
(1)Ti元素在元素周期表中的位置是第______周期第___ ____族,
其基态原子的电子排布式为________。
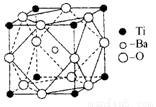
(2)在Ti的化合物中,可以呈现+2、+3、+4三种化合价,其中以+4价的Ti最为稳定。偏钛酸钡的热稳定性好,介电常数高,在小型变压器、话筒和扩音器中都有应用.偏钛酸钡晶体中晶胞的结构示意图如图所示,它的化学式是 ,其中Ti4+的氧配位数为 ,Ba2+的氧配位数为 ;
(3)常温下的TiCl4是有刺激性臭味的无色透明液体,熔点-23.2℃,沸点136.2℃,所以TiCl4应是 化合物,其固体是 晶体。TiCl4在潮湿空气中易挥发,水解而冒白烟,这是因为水解后有________生成。
(4)已知Ti3+可形成配位数为6的配合物,其空间构型为正八面体,如下图1所示,我们通常可以用下图2所示的方法来表示其空间构型(其中A表示配体,M表示中心原子)。配位化合物[Co(NH3)4Cl2]的空间构型也为八面体型,它有 种同分异构体,请在下图方框中将其画出。

查看答案和解析>>
科目:高中化学 来源:2016届贵州省高三十二模理科化学试卷(解析版) 题型:实验题
我国化工专家侯德榜的“侯氏制碱法”曾为世界制碱工业做出了突出贡献。他以NaCl、NH3 、CO2等为原料先制得NaHCO3,进而生产出纯碱。有关反应的化学方程式为:NH3 + CO2 + H2O = NH4HCO3 ; NH4HCO3 + NaCl = NaHCO3↓+ NH4Cl ; 2NaHCO3 = Na2CO3 + CO2↑+ H2O
(1)碳酸氢铵与饱和食盐水反应,能析出碳酸氢钠晶体的原因是 (填标号)。
A.碳酸氢钠难溶于水 B.碳酸氢钠受热易分解
C.碳酸氢钠的溶解度相对较小,所以在溶液中首先结晶析出
(2)某探究活动小组根据上述制碱原理,进行碳酸氢钠的制备实验,同学们按各自设计的方案实验。
① 一位同学将二氧化碳气体通入含氨的饱和食盐水中制备碳酸氢钠,实验装置如下图所示(图中夹持、固定用的仪器未画出)。

试回答下列有关问题:
 (Ⅰ)乙装置中的试剂是 ;
(Ⅰ)乙装置中的试剂是 ;
(Ⅱ)丁装置中稀硫酸的作用是 。
(Ⅲ)实验结束后,分离出NaHCO3 晶体的操作是 (填分离操作的名称)。
② 另一位同学用图中戊装置(其它装置未画出)进行实验。
(Ⅰ)实验时,须先从 管通入 气体,再从 管中通入 气体。
(Ⅱ)有同学建议在戊装置的b管下端连接己装置,理由是 .
(3)请你再写出一种实验室制取少量碳酸氢钠的方法: .
查看答案和解析>>
科目:高中化学 来源:2016届广西柳州铁路一中高三5月月考理科化学试卷(解析版) 题型:实验题
硝酸铜是常用的一种无机化学试剂
(1)工业上以粗铜为原料采取如图所示流程制备硝酸铜晶体:

①在步骤a中,还需要通入氧气和水,其目的是__________
②在保温去铁的过程中,为使Fe3+沉淀完全,可以向溶液中加入CuO调节溶液的pH,根据下表数据,溶液的pH应保持在_________范围

③在滤液蒸发浓缩步骤中,适当加入稀硝酸的作用是__________________________
(2)某研究学习小组将一定质量的硝酸铜晶体【Cu(NO3)2•6H O】放在坩埚中加热,在不同温度阶段进行质量分析,绘制出剩余固体质量分数与温度关系如下图所示。据图回答下列问题:
O】放在坩埚中加热,在不同温度阶段进行质量分析,绘制出剩余固体质量分数与温度关系如下图所示。据图回答下列问题:
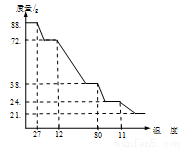
①当温度27℃<T<120℃时,反应的化学方程式为________②剩余固体质量为38.4g时,固体成分为【Cu(NO3)2•2Cu(OH)2】,当温度120℃<T<800℃时,反应的化学方程式为________ (此温度下,HNO 也分解)③当剩余固体质量为21.6g时,固体的化学式为_____________________
也分解)③当剩余固体质量为21.6g时,固体的化学式为_____________________
(3)制备无水硝酸铜的方法之一是用Cu与液态N O
O 反应,反应过程中有无色气体放出,遇到空气变红棕色。反应的化学方程式是_________________
反应,反应过程中有无色气体放出,遇到空气变红棕色。反应的化学方程式是_________________
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北武邑中学高一下第二次月考化学试卷(解析版) 题型:简答题
I.一定温度下将6mol的A及6molB混合于2L的密闭容器中,发生如下反应:3A(g)+B(g) xC(g)+2D(g),经过5分钟后反应达到平衡,测得A的转化率为60%,C的平均反应速率是0.36mol/(L·min)。求:
xC(g)+2D(g),经过5分钟后反应达到平衡,测得A的转化率为60%,C的平均反应速率是0.36mol/(L·min)。求:
(1)平衡时D的浓度= ,
(2)B的平均反应速率v(B)= ,
(3)x= ,
(4)开始时容器中的压强与平衡时的压强之比为 (化为最箭整数比)
II.将CH4设计成燃料电池,装置如图所示(A、B为多孔碳棒)
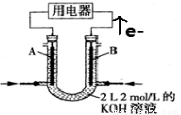
(5) (填A或B)处电极入口通甲烷,其电极反应式为 ;
(6)当消耗甲烷的体积为11.2 L(标准状况下)时,则消耗KOH的物质的量为 。
(7)以NH3代替氢气研发燃料电池是当前科研的一个热点。使用的电解质溶液是2mol·L-1的KOH溶液,电池总反应为:4NH3+3O2=2N2+6H2O。该电池负极的电极反应式为 ;每消耗3.4gNH3转移的电子数目为 。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江苏省高一下第二次月考化学试卷(解析版) 题型:选择题
下列有关实验操作、现象或结论的叙述正确的是________________
A.制备硝基苯的实验中, 水浴加热可以较好的保持恒温条件。
B.乙醇的催化氧化实验中铜丝主要起氧化剂的作用。
C.制取乙酸乙酯时,试剂加入的顺序是:先加入乙醇,后慢慢加入浓硫酸,最后加入乙酸。
D.在蔗糖溶液中加入少量稀硫酸,水浴加热后,再加入银氨溶液,热水浴加热,没有银镜生成,说明蔗糖没有水解。
E.除去甲烷中混有的少量乙烯,可以将混合气体通过酸性KMnO4溶液
F.用钠可以检验某无水酒精中是否含有水
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com