
| A. | 水;无水CaCl2 固体 | B. | 饱和NaHCO3 溶液; 浓H2SO4 | ||
| C. | 浓H2SO4; 饱和NaHCO3 溶液 | D. | 饱和NaHCO3 溶液; 稀H2SO4 |
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:2016-2017学年湖北省高二上10月月考化学试卷(解析版) 题型:实验题
用中和滴定法测定烧碱的纯度,试根据实验回答:
(1)准确称取4.1g烧碱样品,所用主要仪器是 。
(2)将样品配成250mL待测液,需要的仪器有 。
(3)取10.00mL待测液,用 量取。
(4)用0.2010mol·L-1标准盐酸滴定待测烧碱溶液,滴定时 手旋转酸式滴定管的玻璃活塞, 手不停地摇动锥形瓶,两眼注视 ,直到滴定终点。
(5)根据下列数据,计算待测烧碱溶液的浓度为: ,样品烧碱的质量分数为________________。(假设烧碱中不含有与酸反应的杂质)
滴定次数 | 待测液体积 (mL) | 标准盐酸体积(mL) | |
滴定前读数(mL) | 滴定后读数(mL) | ||
第一次 | 10.00 | 0.50 | 20.40 |
第二次 | 10.00 | 4.00 | 24.10 |
(6)滴定过程(酚酞作指示剂),下列情况会使测定结果偏高的是 。
①酸式滴定管用水洗后便装液体进行滴定;②碱式滴定管水洗后,就用来量取待测液;③锥形瓶用蒸馏水洗涤后,又用待测液润洗;④滴定过快成细流、将碱液溅到锥形瓶壁而又未摇匀洗下;⑤盐酸在滴定时溅出锥形瓶外;⑥滴加盐酸,溶液颜色褪去但不足半分钟又恢复红色;⑦滴定前,酸式滴定管有气泡,滴定后消失;⑧记录起始体 积时,仰视读数,终点时俯视。
积时,仰视读数,终点时俯视。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南省高二上第一次月考化学卷(解析版) 题型:选择题
少量铁粉与100mL0.01mol/L的稀盐酸反应,反应速率太慢。为了加快此反应速率而不改变H2的量,可以使用如下方法中的
①加H2O ②加NaOH固体 ③滴入几滴浓盐酸
④加CH3COONa固体 ⑤加NaCl溶液 ⑥滴入几滴硫酸铜溶液
⑦升高温度(不考虑盐酸挥发) ⑧改用10mL0.1mol/L盐酸
A.①⑥⑦ B.③⑤⑧ C.③⑦⑧ D.⑤⑦⑧
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol C(金刚石)中含有C-C键的数目为2NA | |
| B. | 当有0.4 mol Na参与反应时,被还原的CO2为0.3NA | |
| C. | 金刚石与石墨之间的转化为化学变化 | |
| D. | X的化学式为Na2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| t/℃ | 5 | 15 | 25 | 35 | 50 |
| K | 1100 | 841 | 680 | 533 | 409 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
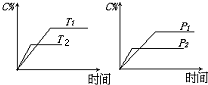 可逆反应mA(s)+nB(g)?eC(g)+fD(g),反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如图,下列叙述正确的是( )
可逆反应mA(s)+nB(g)?eC(g)+fD(g),反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如图,下列叙述正确的是( )| A. | 达平衡后,加入催化剂则C%增大 | |
| B. | 达平衡后,若升温,平衡向逆方向移动 | |
| C. | 化学方程式中n>e+f | |
| D. | 达平衡后,增加A的量有利于平衡向正方向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
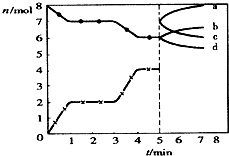
| A. | CO在2-3min和4-5min时平均速率相等 | |
| B. | 当固焦炭的质量不发生变化时,说明反应已达平衡状态 | |
| C. | 5min时再充入一定量的CO,n(CO)、n(CO2)的变化可分别由c、b曲线表示 | |
| D. | 3min时温度由T1升高到T2,重新平衡时K(T2)小于K(T1) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 物质 | 杂质 | 除去杂质所用的试剂和方法 |
| A | 碳酸钠粉末 | 碳酸钙粉末 | 加足量水过滤、蒸发 |
| B | 二氧化碳 | 氧气 | 点燃混合气体 |
| C | 铁 | 氧化铁 | 加足量盐酸蒸发 |
| D | 氯化铁溶液 | 氯化铜 | 加足量铁粉过滤 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com