
| A、反应A2(g)+3B2(g)═2AB3(g)在一定温度下能自发进行,则该反应的△H<0 |
| B、将NH3 通入热的CuSO4 溶液中能使Cu2+还原成Cu |
| C、钙和镁的氯化物溶液蒸发结晶出来的固体都是水合物,经焙烧得相应无水盐 |
| D、用酸溶解金属铝时,溶解的速率与铝的纯度有关,纯度越高速率越大 |


科目:高中化学 来源: 题型:
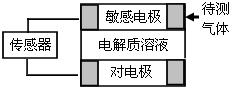 气体的自动化检测中常常应用原电池原理.如图为该电池工作的示意图:气体扩散进入敏感电极,发生反应,传感器就会接收到电信号.下表列出了待测气体及敏感电极上部分反应产物.(对电极:即与敏感电极对应相反的电极)则下列说法中正确的是( )
气体的自动化检测中常常应用原电池原理.如图为该电池工作的示意图:气体扩散进入敏感电极,发生反应,传感器就会接收到电信号.下表列出了待测气体及敏感电极上部分反应产物.(对电极:即与敏感电极对应相反的电极)则下列说法中正确的是( )| 待测气体 | 部分电极反应产物 |
| NO2 | NO |
| Cl2 | HCl |
| CO | CO2 |
| H2S | H2SO4 |
| A、检测Cl2时,电解质溶液中的阴离子向敏感电极移动 |
| B、上表气体检测时,敏感电极均作电池正极 |
| C、检测含相同物质的量的H2S和CO两份空气样本时,传感器上流过的电子物质的量之比为4:1 |
| D、检测H2S气体时,在对电极上充入空气,对电极上的电极反应式为:O2+2H2O+4e-═4OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:
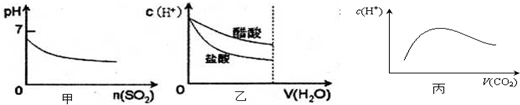
| A、甲是向溴水通入S02气体时,pH与S02物质的量的关系图 |
| B、乙是向c(H+)相同的醋酸和盐酸滴入水时,c(H+)与水体积的关系图 |
| C、常温常压下,将2b mol CO2气体通入1L b mol?L-1的NaOH溶液中,随着CO2气体的通入,溶液中由水电离出的c(H+)有如丙图变化关系 |
| D、向硝酸钠溶液中滴加稀盐酸得到的pH=5的混合溶液中:c(Na+)>c(NO3-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、
| ||
| B、0.1mol?L-1 FeCl3溶液:NH4+、H+、I-、SCN- | ||
| C、0.1mol?L-1 Na2CO3溶液:K+、Ca2+、HCO3-、SO42- | ||
| D、使酚酞变红色的溶液:Na+、Ba2+、NO3-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、工业上一般以铁矿石、焦炭、石灰石和空气等原料在高炉中冶炼生铁 |
| B、炼钢主要目的是在高温下用还原剂将过多的碳和其他杂质还原成气体或炉渣除去 |
| C、炼钢中添加硅、锰、铝等作为脱氧剂,调整钢水的成分,制成多种性能优良的钢材 |
| D、电解铝时阴极材料需要定期更换. |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 装 置 | 现 象 |
 |
ⅰ.实验初始,未见明显现象 ⅱ.过一会儿,出现气泡,液面上方呈浅棕色 ⅲ.试管变热,溶液沸腾 |
| 实 验 | 内 容 | 现 象 |
| 实验1 | 将湿润KI-淀粉试纸置于空气中 | 未变蓝 |
| 实验2 | 用湿润KI-淀粉试纸检验浅棕色气体 | 试纸变蓝 |
| 装 置 | 现 象 |
 |
ⅰ.实验初始,未见明显现象 ⅱ.过一会儿,出现气泡,有刺激性气味 |
查看答案和解析>>
科目:高中化学 来源: 题型:
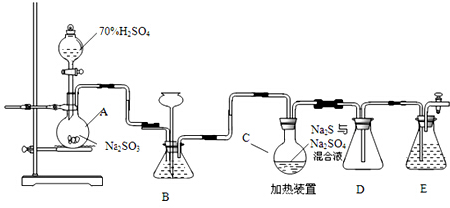
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
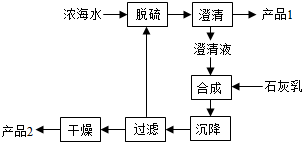
| 离子 | Na+ | Mg2+ | Cl- | SO42- |
| 浓度/(g?L-1) | 63.7 | 28.8 | 144.6 | 46.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Z与Y两种元素组成的化合物中,阴、阳离子个数比为1:1或1:2 |
| B、Y、Z、W元素形成的简单离子具有相同电子层结构,其离子半径依次增大 |
| C、Z、R元素的氧化物的水化物之间相互反应生成的盐溶液呈中性、碱性或酸性 |
| D、Y、R元素分别与X元素形成的化合物的沸点:XmY<XmR |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com