
| A、普通锌锰干电池中碳棒为正极 |
| B、铅蓄电池中覆盖着PbO2的电极板是负极板 |
| C、氢氧燃料电池的正极是通入氧气的那一极 |
| D、碱性锌锰干电池的比能量和储存时间比普通锌锰干电池高 |


 启东小题作业本系列答案
启东小题作业本系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、C2H2、C2H4 |
| B、C2H6、C3H8 |
| C、C2H4、C3H6 |
| D、CH4、C2H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1L 1mol?L-1 CuCl2溶液中含有的氯离子数为NA |
| B、常温常压下,11.2L氢气气体中含有的分子数为0.5NA |
| C、1mol氯气与足量的水完全反应转移的电子数为2NA |
| D、标准状况下,1mol乙烷和乙烯的混合气中含有的碳原子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、K+、Na+、AlO2-、CO32- |
| B、Na+、Cl-、SiO32-、K+ |
| C、Na+、NO3-、AlO2-、K+ |
| D、Na+、Cl-、HCO3-、Ba2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、a>b>c>d |
| B、a>c>d>b |
| C、c>a>b>d |
| D、b>d>c>a |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、4 mol/L |
| B、3.5 mol/L |
| C、3 mol/L |
| D、2 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、 如图装置可用于从Fe(OH)3胶体中过滤出Fe(OH)3胶粒 |
B、 如图装置可用于干燥、收集氨气,并吸收多余的氨气 |
C、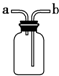 如图装置可用于排空气法收集NO2气体 |
D、 如图装置可用于证明Cl2易与NaOH溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 某实验小组设计用50mL 1.0mol/L盐酸跟50mL 1.1mol/L 氢氧化钠溶液在如图装置中进行中和反应.在大烧杯底部垫碎泡沫塑料(或纸条),使放入的小烧杯杯口与大烧杯杯口相平.然后再在大、小烧杯之间填满碎泡沫塑料(或纸条),大烧杯上用泡沫塑料板(或硬纸板)作盖板,在板中间开两个小孔,正好使温度计和环形玻璃搅拌棒通过.通过测定反应过程中所放出的热量可计算中和热.试回答下列问题:
某实验小组设计用50mL 1.0mol/L盐酸跟50mL 1.1mol/L 氢氧化钠溶液在如图装置中进行中和反应.在大烧杯底部垫碎泡沫塑料(或纸条),使放入的小烧杯杯口与大烧杯杯口相平.然后再在大、小烧杯之间填满碎泡沫塑料(或纸条),大烧杯上用泡沫塑料板(或硬纸板)作盖板,在板中间开两个小孔,正好使温度计和环形玻璃搅拌棒通过.通过测定反应过程中所放出的热量可计算中和热.试回答下列问题:| 实验序号 | 起始温度t1/℃ | 终止温度(t2)/℃ | 温差(t2-t1)/℃ | ||
| 盐酸 | NaOH溶液 | 平均值 | |||
| 1 | 25.1 | 24.9 | 25.0 | 31.6 | 6.6 |
| 2 | 25.1 | 25.1 | 25.1 | 31.8 | 6.7 |
| 3 | 25.1 | 25.1 | 25.1 | 31.9 | 6.8 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com