
【题目】(1)下列各组物质中,互为同位素的是_____(填序号,下同),互为同系物的是_____,互为同分异构体的是_____。
①红磷与白磷 ②35Cl与37Cl ③CH3COOCH3与CH3CH2COOCH3④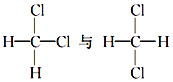 ⑤
⑤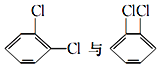 ⑥
⑥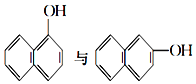 ⑦乙醇与二甲醚
⑦乙醇与二甲醚
(2)按系统命名法给下列有机物命名:
①CH3CH(C2H5)CH(CH3)2:_____。
②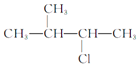 _____
_____
③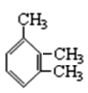 _____
_____
(3)写出下列有机反应的方程式:
①1,3-丁二烯的加聚反应:_____
②3-甲基-2-丁醇的催化氧化反应:_____
③甲醛与新制氢氧化铜反应:_____
【答案】② ③ ⑥⑦ 2,3-二甲基戊烷 3-甲基-2-氯丁烷 1,2,3-三甲基苯 nCH2=CH-CH=CH2![]()
![]() 2
2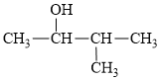 +O2
+O2![]() 2
2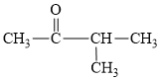 +2H2O HCHO+4Cu(OH)2+2NaOH
+2H2O HCHO+4Cu(OH)2+2NaOH![]() 2Cu2O↓+Na2CO3+6H2O
2Cu2O↓+Na2CO3+6H2O
【解析】
(1)35Cl和37Cl中子数不同,是氯元素的不同核素,互为同位素;CH3COOCH3和CH3CH2COOCH3结构相似,相差1个CH2原子团,互为同系物;⑥中两种物质分子式相同,结构不同,为官能团位置异构,⑦乙醇与二甲醚,两种物质分子式相同,结构不同,为官能团异构,故属于同分异构的选⑥⑦;故答案为:②;③;⑥⑦;
(2)①主链5个碳,2,3号位置有两个甲基,名称为2,3-二甲基戊烷,故答案为:2,3-二甲基戊烷;
②主链4个碳,3号位置有1个甲基,2号位有氯原子,名称为:3-甲基-2-氯丁烷,故答案为:3-甲基-2-氯丁烷;
③苯环上有三个甲基,以苯环为母体,在1,2,3号位置分别有一个甲基,名称为1,2,3-三甲基苯,故答案为:1,2,3-三甲基苯;
(3)①1,3-丁二烯发生加聚反应的化学方程式为:nCH2=CH-CH=CH2![]()
![]() ;
;
②3-甲基-2-丁醇的催化氧化反应中与羟基相连接的碳原子上有1个H原子,因此被氧化为酮,其反应方程式为:2 +O2
+O2![]() 2
2 +2H2O;
+2H2O;
③甲醛与新制氢氧化铜反应,甲醛被氧化为碳酸钠,氢氧化铜被还原为氧化亚铜,其反应方程式为:HCHO+4Cu(OH)2+2NaOH![]() 2Cu2O↓+Na2CO3+6H2O。
2Cu2O↓+Na2CO3+6H2O。


科目:高中化学 来源: 题型:
【题目】下列有关化学反应与能量变化的说法正确的是( )
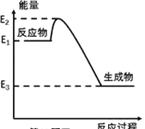
A.如图所示的化学反应中,反应物的键能之和大于生成物的键能之和
B.相同条件下,氢气和氧气反应生成液态水比生成等量的气态水放出的热量少
C.金刚石在一定条件下转化成石墨能量变化如图所示,热反应方程式可为:C(s,金刚石)=C(s,石墨)H=E2-E1) kJ/mol
D.同温同压下,H2(g)+Cl2(g)=2HCl(g)能量变化如图所示,在光照和点燃条件的△H相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】瑞巴匹特为新型抗溃疡药,它可保护胃肠黏膜免受各种致溃疡因子的危害,其合成路线如图:
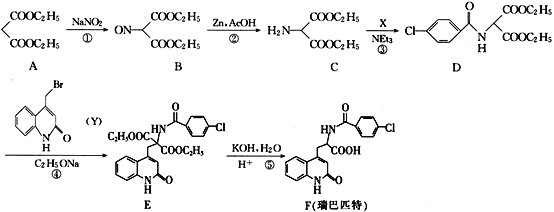
(1)A的化学名称为__,A与足量的NaOH溶液反应的化学方程式__。
(2)化合物D中含氧官能团的名称为__。
(3)反应①~④中,属于取代反应的是__(填序号)。
(4)C→D的转化中,生成的另一种产物为HCl,则X的结构简式为__。
(5)已知Y中的溴原子被-OH取代得到Z,写出同时满足下列条件的Z的一种同分异构体的结构简式:__。
Ⅰ.分子中含有一个苯环和一个五元环,且都是碳原子形成环;
Ⅱ.苯环上的一氯代物只有两种;
Ⅲ.能与NaHCO3溶液发生反应。
(6)已知:CH3CH2OH![]() CH3CH2Br,请写出以A和HOCH2CH2CH2OH为原料制备
CH3CH2Br,请写出以A和HOCH2CH2CH2OH为原料制备![]() 的合成路线流程图___(无机试剂任用)。
的合成路线流程图___(无机试剂任用)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国化学家侯德榜发明的“侯氏制碱法”联合合成氨工业生产纯碱和氮肥,工艺流程图如下。碳酸化塔中的反应:NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl。

下列说法不正确的是
A.以海水为原料,经分离、提纯和浓缩后得到饱和氯化钠溶液进入吸氨塔
B.碱母液储罐“吸氨”后的溶质是NH4Cl和NaHCO3
C.经“冷析”和“盐析”后的体系中存在平衡 NH4Cl(s) ![]() NH4+(aq) + Cl-(aq)
NH4+(aq) + Cl-(aq)
D.该工艺的碳原子利用率理论上为 100%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究不同 pH 时 CuSO4 溶液对 H2O2 分解的催化作用。资料:a.Cu2O 为红色固体,难溶于水,能溶于硫酸,生成 Cu 和Cu2+。b.CuO2 为棕褐色固体,难溶于水,能溶于硫酸,生成 Cu2+和 H2O2。c.H2O2 有弱酸性:H2O2 ![]() H+ +HO2-,HO2-
H+ +HO2-,HO2- ![]() H+ +O22-。
H+ +O22-。
编号 | 实验 | 现象 |
Ⅰ | 向 1 mL pH=2 的 1 mol·L 1 CuSO4溶液中加入 0.5 mL 30% H2O2 溶液 | 出现少量气泡 |
Ⅱ | 向 1 mL pH=3 的 1 mol·L 1 CuSO4溶液中加入 0.5 mL 30% H2O2 溶液 | 立即产生少量棕黄色沉淀,出现较明显气泡 |
Ⅲ | 向 1 mL pH=5 的 1 mol·L 1CuSO4溶液中加入 0.5 mL 30% H2O2 溶液 | 立即产生大量棕褐色沉淀,产生大量气泡 |
(1) 经检验生成的气体均为 O2,Ⅰ中 CuSO4 催化分解 H2O2 的化学方程式是__。
(2)对Ⅲ中棕褐色沉淀的成分提出 2 种假设:ⅰ.CuO2,ⅱ.Cu2O 和CuO2 的混合物。为检验上述假设,进行实验Ⅳ:过滤Ⅲ中的沉淀,洗涤,加入过量硫酸,沉淀完全溶解,溶液呈蓝色,并产生少量气泡。
①若Ⅲ中生成的沉淀为 CuO2,其反应的离子方程式是__。
②依据Ⅳ中沉淀完全溶解,甲同学认为假设ⅱ不成立,乙同学不同意甲同学的观点,理由是__。
③为探究沉淀中是否存在 Cu2O,设计如下实验:
将Ⅲ中沉淀洗涤、干燥后,取 a g 固体溶于过量稀硫酸,充分加热。冷却后调节溶液 pH,以 PAN 为指示剂,向溶液中滴加 c mol·L 1EDTA 溶液至滴定终点,消耗 EDTA 溶液 V mL。V=__,可知沉淀中不含 Cu2O,假设ⅰ成立。(已知:Cu2++EDTA= EDTA-Cu2+,M(CuO2)=96 g·mol 1,M(Cu2O)=144 g·mol1)
(3)结合方程式,运用化学反应原理解释Ⅲ中生成的沉淀多于Ⅱ中的原因__ 。
(4)研究Ⅰ、Ⅱ、Ⅲ中不同 pH 时 H2O2 分解速率不同的原因。
实验Ⅴ:在试管中分别取 1 mL pHspan>=2、3、5 的 1 mol·L1 Na2SO4 溶液,向其中各加入 0.5 mL 30% H2O2 溶液,三支试管中均无明显现象。
实验Ⅵ:__(填实验操作和现象),说明 CuO2 能够催化 H2O2 分解。
(5)综合上述实验,Ⅰ、Ⅱ、Ⅲ中不同 pH 时 H2O2 的分解速率不同的原因是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了配制![]() 的浓度与Cl-的浓度比为1:1的溶液,可在NH4Cl溶液中加入
的浓度与Cl-的浓度比为1:1的溶液,可在NH4Cl溶液中加入
①适量的HCl ②适量的NaCl ③适量的氨水 ④适量的NaOH
A.①②B.③C.③④D.④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】周期表前四周期的元素 A、B、C、D、E,原子序数依次增大。A的核外电子总数与其期序数相同,B和D位于同一周期且未成对电子数等于其周期序数,E为第四周期元素,最外层只有一个电子,次外层的所有轨道均充满电子。
(1)B、C、D三种元素第一电离能由大到小的顺序为___(填元素符号),E基态原子价层电子排布图为_____。
(2)写出由以上元素组成的BD2的等电子体的分子 _________。
(3)已知D可形成D3+离子,该离子中心原子杂化方式为___,立体构型为__。
(4)温度接近沸点时,D的简单氢化物的实测分子量明显高于用原子量和化学式计算出来的分子量,原因是 _______。
(5)无色的[E(CA3)2]+在空气中不稳定、立即被氧化成深蓝色的[E (CA3)4]2+,利用这个性质可除去气体中的氧气,该反应的离子方程为________。
(6)已知E和D形成的一种晶体胞结构如图所示,已知晶胞边长为anm,阿伏加德罗常数为NA,则该晶体的密度为_________ g/cm3(列出计算表达式即可)。
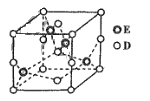
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,AgCl(s)![]() Ag+(aq)+Cl-(aq)在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是
Ag+(aq)+Cl-(aq)在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是

A.c点对应的Ksp等于a点对应的Ksp
B.加入AgNO3,可以使溶液由c点变到d点
C.d点没有AgCl沉淀生成
D.加入少量水,平衡右移,Cl-浓度减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA表示阿伏加德罗常数的值。下列说法正确的是
A.39g苯蒸气含碳碳双键的数目为1.5NA
B.将1molNH4NO3溶于适量稀氨水中,所得溶液呈中性,则溶液中NH4+的数目为NA
C.高温下,16.8gFe与足量水蒸气完全反应,转移的电子数为0.45NA
D.电解饱和食盐水消耗2molNaCl,加入含2mol HCl的盐酸可恢复到电解前的状态
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com