
����Ŀ����һ������NaOH��Һ����μ���AlCl3��Һ�����ɳ���Al��OH��3������AlCl3�������ı仯��ϵ��ͼ��ʾ���������������ڶ�Ӧ����Һ��һ���ܴ���������ǣ� ��
A��a���Ӧ����Һ�У�Na+��Fe3+��SO42����HCO3��
B��b���Ӧ����Һ�У�Na+��S2����SO42����Cl��
C��c���Ӧ����Һ�У�Ag+��Ca2+��NO3����Na+
D��d���Ӧ����Һ�У�K+��NH4+��I����HCO3��

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��CO���ִ����������Ļ���ԭ�ϣ������й����ⶼ��CO��ʹ���йء�
��1�� ��ҵ�Ͽ�����CO�����Ҵ�:
2CO��g����4H2��g��![]() CH3CH2OH��g����H2O��g�� ��H1
CH3CH2OH��g����H2O��g�� ��H1
����֪��H2O��l��=== H2O��g�� ��H2
CO��g����H2O��g��![]() CO2��g����H2��g�� ��H3
CO2��g����H2��g�� ��H3
��ҵ��Ҳ������CO2��g����H2��g��Ϊԭ�Ϻϳ��Ҵ���
2CO2��g����6H2��g��![]() CH3CH2OH��g����3H2O��l�� ��H
CH3CH2OH��g����3H2O��l�� ��H
����H����H1����H2����H3֮��Ĺ�ϵ�ǣ���H��___________________��
��2��һ�������£�H2��CO������̶����ܱ������з������·�Ӧ��
4H2��g��+2CO��g��![]() CH3OCH3��g��+H2O��g��������ѡ�����жϸ÷�Ӧ�ﵽƽ��״̬�����ݵ���___ ��
CH3OCH3��g��+H2O��g��������ѡ�����жϸ÷�Ӧ�ﵽƽ��״̬�����ݵ���___ ��
A��2v��H2��= v��CO��
B��CO���������ʵ���CH3OCH3����������
C�������ڵ�ѹǿ���ֲ���
D�����������ܶȱ��ֲ���
E����������ƽ����Է�����������ʱ����仯
��3����ҵ�ɲ���CO��H2��Ӧ�ϳ�������Դ�״�����Ӧ����:
CO��g��+ 2H2��g��![]() CH3OH��g����һ�ݻ��ɱ���ܱ������г���10molCO��20molH2���ڴ��������·�����Ӧ���ɼ״���CO��ƽ��ת���ʣ��������¶ȣ�T����ѹǿ��p���Ĺ�ϵ�磨ͼ1����ʾ��
CH3OH��g����һ�ݻ��ɱ���ܱ������г���10molCO��20molH2���ڴ��������·�����Ӧ���ɼ״���CO��ƽ��ת���ʣ��������¶ȣ�T����ѹǿ��p���Ĺ�ϵ�磨ͼ1����ʾ��
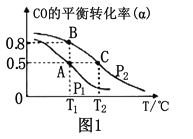
���ϳɼ״��ķ�ӦΪ ��������������������������Ӧ��
��A��B��C�����ƽ�ⳣ��KA��KB��KC�Ĵ�С��ϵΪ ��
�����ﵽƽ��״̬Aʱ�����������Ϊ10L������ƽ��״̬Bʱ���������Ϊ_________L��
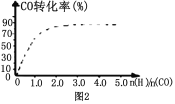
����ͼ2��������Ϊ�÷�Ӧ��ʹ�ô��������¹�����ʼ������COͶ�ϱȺ�COƽ��ת���ʵĹ�ϵͼ�� ����������ȫ��ͬʱ����ʵ������ʹ�ô��������COƽ��ת���ʵ�ʾ��ͼ��
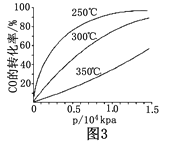
��CO��ƽ��ת���ʣ��������¶ȣ�T����ѹǿ��p���Ĺ�ϵ�磨ͼ3����ʾ��ʵ������ʱ����������250 ���� 1.3��104 kPa���ң�ѡ���ѹǿ��������__________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
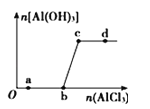
����Ŀ����20 mL AlC13��Һ�е���2 mol / L Na0H ��Һʱ���õ����������������μ�NaOH��Һ���������ͼ��ʾ��ϵ��

��1��ͼ��A���ʾ��������_____________��
��2��ͼ��B ���ʾ��������_____________��
��3������Һ����Al(OH) 3����0.39g�������ȥNaOH ��Һ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ô���ʯ��ĩ��3mol/L���ᷴӦ��ȡCO2���壬��Ҫ����Ӧ���ʣ��ɲ�ȡ�Ĵ�ʩ�ǣ��� ����
A. ����ˮ B. ����1mol/L���� C. ���ÿ�״����ʯ D. �ʵ������¶ȣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ӷ���ʽ��ȷ������ ��
A����������������ϡ���3Fe2++4H++NO3���T3Fe3++NO��+3H2O
B����NaAlO2��Һ��ͨ�����CO2��Al��OH��3��AlO2��+CO2+2H2O�TAl��OH��3��+HCO3-
C����Ũ������MnO2��Ӧ��ȡ����������MnO2+2H++2Cl��![]() Mn2++Cl2��+2H2O
Mn2++Cl2��+2H2O
D����ǿ����Һ�д���������Fe��OH��3��Ӧ����Na2FeO4��3ClO��+2Fe��OH��3�T2FeO42��+3Cl��+H2O+4H+
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ���¶���,�����������Ϊ1.0 L �ĺ����ܱ������з�����Ӧ:2A(g�� ![]() B(g��+C(g��
B(g��+C(g��
���� ��� | �¶� (���� | ��ʼ���ʵ���(mol�� | ƽ�����ʵ���(mol�� | |
A(g�� | B(g�� | C(g�� | ||
�� | 387 | 0. 20 | 0. 080 | 0. 080 |
�� | 387 | 0. 40 | ||
�� | 207 | 0. 20 | 0. 090 | 0. 090 |
����˵������ȷ������ ��
A. �÷�Ӧ������ӦΪ���ȷ�Ӧ
B. �ﵽƽ��ʱ,�������е�A����������������е���ͬ
C. �������з�Ӧ����ƽ������ʱ����������еĶ�
D. ����ʼʱ���������г���0.15 mol A��0.15 mol B��0.10 mol C��Ӧ�����淴Ӧ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ȤС��ͬѧ���о�SO2��������ʡ�
��1���Ƚ��±��е��������ʹ�ϵ����2��������X�Ļ�ѧʽ�� ��
��1�� | ��2�� |
C��CO��CO2��H2CO3��Na2CO3����NaHCO3�� | S ��SO2��SO3��X��Na2SO4��NaHSO4 |
��2��������ͼװ��������SO2������
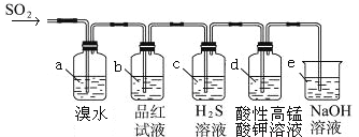
��װ��a�е������ǣ� �� ����ܡ����ܡ���˵�� SO2 ��Ư����
����װ��e����40 mL 2��5 molL��1 NaOH��Һ����Ӧ������4��8 g����װ��IV�з�����Ӧ���ܻ�ѧ����ʽ�� ��
��3����С��ļס�����λͬѧ������ͼװ�ü���̽��SO2������Ư���ԣ�
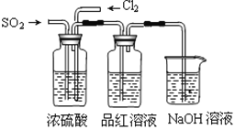
ͨ��һ��ʱ���ͬѧʵ�������Ʒ����Һ��������ɫ������ͬѧ��ʵ��������Ʒ����Һ��ʱ������Ʊ��Խ��Խdz���Ը��ݸ�ʵ��װ�ú�����ͬѧ��ʵ�����ش����⡣
���Է�����ͬѧʵ������У������ӷ���ʽ��ʾƷ����Һ����ɫ��ԭ���ǣ� ��
������Ϊ��ͬѧ������������Ʒ����Һ���Խ��Խdz�ģ�
��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ijͬѧ�ⶨ��ѧ��Ӧ���ʲ�̽����Ӱ�����ص�ʵ�顣
��.�ⶨ��ѧ��Ӧ����
��ͬѧ������ͼװ�òⶨ��ѧ��Ӧ���ʡ�
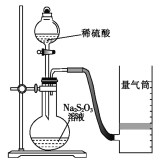
����֪��S2O32-��2H�� = H2O��S����SO2����
��1������ͼ��ʾ��ʵ����Ʒ�������⣬����Ҫ��һ��ʵ��������__________________��
��2������2 minʱ�ռ���224 mL��������ɱ�״�������壬�ɼ������2 min��H���ķ�Ӧ���ʣ����òⶨֵ��ʵ��ֵƫС����ԭ���� ��
��3���Լ����ⶨ�÷�Ӧ�Ļ�ѧ��Ӧ���ʵ����������� ��дһ������
��.Ϊ̽�ֻ�ѧ��Ӧ���ʵ�Ӱ�����أ���Ƶ�ʵ�鷽�����±���
����֪ I2��2S2O32- = S4O62-��2I��������Na2S2O3��Һ��������
ʵ����� | ���V/mL | ʱ��/s | |||
Na2S2O3��Һ | ������Һ | ��ˮ | ˮ | ||
�� | 10.0 | 2.0 | 4.0 | 0.0 | t1 |
�� | 8.0 | 2.0 | 4.0 | 2.0 | t2 |
�� | 6.0 | 2.0 | 4.0 | Vx | t3 |
��4����ʵ����е�Ŀ���� ��������Һ�������� ������Vx�� mL��ͨ���Ƚ�t1��t2��t3��С�����Ʋ��ʵ����ۣ�
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com