
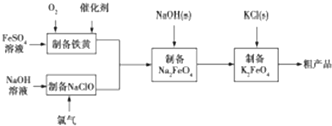
分析 制备高铁酸钾:硫酸亚铁中+2价的铁具有还原性,氧气具有氧化性,两者反应生成铁黄,反应为:4Fe2++O2+6H2O=4FeOOH+8H+,氯气和氢氧化钠反应生成氯化钠、次氯酸钠和水,反应的化学方程式为:Cl2+2NaOH═NaCl+NaClO+H2O,铁黄和次氯酸钠反应生成高铁酸钠,2FeOOH+3NaClO+4NaOH=2Na2FeO4+3NaCl+3H2O,高铁酸钠在溶液中溶解度大于高铁酸钾,加入氯化钾,2KOH+Na2FeO4 =K2FeO4+2NaOH,高铁酸钠在溶液中转化成高铁酸钾,静置,抽滤获得粗产品.
(1)根据反应物和生成物写出反应方程式,电解饱和食盐水反应生成次氯酸钠和氢气;
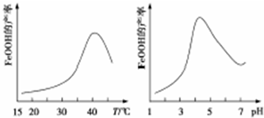
(2)化合价降低元素所在的反应物是氧化剂,化合价升高元素所在的反应物是还原剂,根据方程式进行计算,根据图示的实验测得反应溶液的pH、温度对铁黄产率的影响分析;
(3)高铁酸钾中+6价的铁具有氧化性,可以将CN-氧化为氮气和二氧化碳而除去,根据得失电子守恒和电荷守恒书写离子方程式;
(4)原电池中,失电子的电极是负极,发生氧化反应,充电时,阳极上Fe(OH)3失电子发生氧化反应;
(5)pH为2时,c(OH-)=10-12mol/L,结合Ksp(Fe(OH)3)=c(Fe3+)×c3(OH-)=4.0×10-38计算c(Fe3+);
(6)根据铁元素守恒计算90%的高铁酸钾的质量.
解答 解:(1)电解饱和食盐水,氯气和氢氧化钠充分接触,产物仅是次氯酸钠和氢气,则发生的反应为:NaCl+H2O$\frac{\underline{\;电解\;}}{\;}$NaClO+H2↑,
故答案为:NaCl+H2O$\frac{\underline{\;电解\;}}{\;}$NaClO+H2↑;
(2)硫酸亚铁中+2价的铁具有还原性,铁元素从+2价升高为+3价,亚铁离子为还原剂,氧气具有氧化性,氧元素从0价降低为-2价,氧气为氧化剂,两者反应生成铁黄,反应为:4Fe2++O2+6H2O=4FeOOH+8H+,所以反应中氧化剂与还原剂的物质的量之比为1:4,根据图象,40℃左右时,铁黄产率较高,PH大于4.5时生成了氢氧化铁,使得铁黄产率降低,
故答案为:1:4;40℃;酸性减弱,Fe(OH)3增多;
(3)高铁酸钾具有氧化性,可以将CN-氧化为氮气和二氧化碳而除去,本身被还原为氢氧化铁,在碱性溶液中二氧化碳变成碳酸根离子,反应的方程式为:10FeO42-+6CN-+22H2O=10Fe(OH)3(胶体)+6CO32-+3N2↑+14OH-,
故答案为:10FeO42-+6CN-+22H2O=10Fe(OH)3(胶体)+6CO32-+3N2↑+14OH-;
(4)2K2FeO4+3Zn+8H2O$?_{放电}^{充电}$2Fe(OH)3+3Zn(OH)2+4KOH,锌反应中化合价升高被氧化,失电子,是负极,充电时阳极发生氧化反应,生成高铁酸根离子,电极反应为:Fe(OH)3-3e-+5OH-=FeO42-+4H2O,
故答案为:Zn;Fe(OH)3-3e-+5OH-=FeO42-+4H2O;
(5)PH=2时,C(OH-)=10-12mol/L,根据Ksp[Fe(OH)3]=4.0×10-38,C(Fe3+)=$\frac{4.0×1{0}^{-38}}{(1{0}^{-12})^{3}}$mol/L=0.04mol/L,
故答案为:0.04;
(6)1mol 2mol•L-1FeSO4溶液中含有2molFeSO4,根据铁元素守恒,生成高铁酸钾的质量为:m=2mol×75%×198g/mol÷90%=330kg,
故答案为:330.
点评 本题考查高铁酸钾的制备,题目侧重学生的分析能力和实验能力的考查,注意把握物质的性质以及实验流程,明确发生的离子反应及电解反应是解答的关键,题目难度中等.


 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案科目:高中化学 来源: 题型:解答题
 已知H2C2O4为二元中强酸.某化学兴趣小组为测定含Na2SO4、NaHC2O4和H2C2O4•2H2O的试样中各物质的质量分数,进行了如下实验:
已知H2C2O4为二元中强酸.某化学兴趣小组为测定含Na2SO4、NaHC2O4和H2C2O4•2H2O的试样中各物质的质量分数,进行了如下实验:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 天津港“8.12”爆炸事故中,因爆炸冲击导致氰化钠泄漏,可以通过喷洒双氧水或硫代硫酸钠溶液来处理,以减轻环境污染.
天津港“8.12”爆炸事故中,因爆炸冲击导致氰化钠泄漏,可以通过喷洒双氧水或硫代硫酸钠溶液来处理,以减轻环境污染.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学反应必然伴随着能量的变化 | |
| B. | 能量转化的途径不同时,体系包含的总能量不同 | |
| C. | 放热反应指生成物的总能量高于反应物的总能量 | |
| D. | 吸热反应不加热就不会发生 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
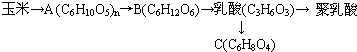
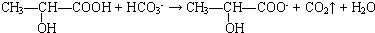
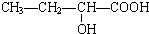 、
、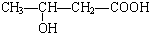 、
、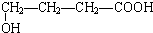
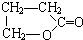 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间 | 开始 | 8小时 | 16小时 | 24小时 | 32小时 | 40小时 | 48小时 |
| pH | 5.0 | 4.8 | 4.5 | 4.3 | 4.2 | 4.0 | 4.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有②④ | B. | 只有④ | C. | 只有② | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在河流入海口处易形成三角州 | |
| B. | 在饱和氯化铁溶液中逐滴加入NaOH溶液,产生红褐色沉淀 | |
| C. | 尿毒症患者做“血液透析” | |
| D. | 用石膏或盐卤点制豆腐 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com