
已知:2H2(g)+O2(g)====2H2O(l)
ΔH=-571.6 kJ·mol-1 ①
2CH3OH(l)+3O2(g)====2CO2(g)+4H2O(l)
ΔH=-1 452 kJ·mol-1 ②
H+(aq)+OH-(aq)====H2O(l) ΔH=-57.3 kJ·mol-1 ③
下列说法正确的是( )
A.H2(g)的燃烧热ΔH=-571.6 kJ·mol-1
B.同质量的H2(g)和CH3OH(l)完全燃烧,H2(g)放出的热量多
C.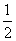 H2SO4(aq)+
H2SO4(aq)+ 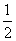 Ba(OH)2(aq)====
Ba(OH)2(aq)====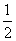 BaSO4(s)+H2O(l) ΔH=-57.3 kJ·mol-1
BaSO4(s)+H2O(l) ΔH=-57.3 kJ·mol-1
D.3H2(g)+CO2(g)====CH3OH(l)+H2O(l) ΔH=+135.9 kJ·mol-1
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
N2+3H2 2NH3是目前工业上合成氨的反应,下列关于该反应的说法正确的是( )
2NH3是目前工业上合成氨的反应,下列关于该反应的说法正确的是( )
|
| A. | 增加N2的浓度能加快反应速率 |
|
| B. | 降低体系温度能加快反应速率 |
|
| C. | 使用催化剂不影响反应速率 |
|
| D. | 若反应在密闭容器中进行,N2和H2能100%转化为NH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
某研究小组在实验室用三份不同初始浓度的氨基甲酸铵(NH2COONH4)溶液在不同温度下进行水解实验:NH2COONH4+2H2O NH4HCO3+
NH4HCO3+
NH3·H2O,测得c(NH2COO-)与反应时间的关系如图所示。据图判断下列说法中正确的是 ( )
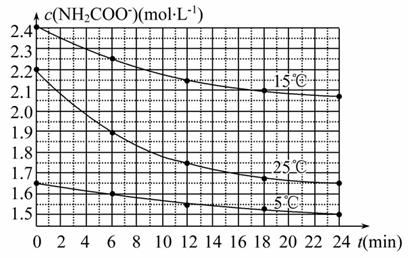
A.0~12 min,初始浓度越大的实验,水解反应速率越大
B.c(NH2COO-)将随反应时间的不断延长而不断减小
C.25 ℃时,0~6 min,v(NH2COO-)为0.05 mol·L-1·min-1
D.15 ℃时,第30 min时,c(NH2COO-)为2.0 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法不正确的是( )
①在热化学方程式中无论是反应物还是生成物都必须标明状态
②所有的化学反应都伴随着能量变化
③放热反应发生时不必加热
④吸热反应在加热后才能发生
⑤化学反应的热效应数值只与参加反应的物质的多少有关
⑥一般来说,吸热反应在一定条件下也能发生
A.②③⑥ B.③④⑤
C.④⑤ D.③④
查看答案和解析>>
科目:高中化学 来源: 题型:
到目前为止,由化学能转变为热能或电能仍然是人类使用最主要的能源。
(1)化学反应中放出的热能(焓变,ΔH)与反应物和生成物在反应过程中断键和形成新键过程中吸收和放出能量的大小有关。
已知:H2(g)+Cl2(g)====2HCl(g) ΔH=-185 kJ·mol-1,断裂1 mol H—H键吸收的能量为436 kJ,断裂1 mol Cl—Cl键吸收的能量为247 kJ,则形成1 mol H—Cl键放出的能量为_________。
(2)燃料燃烧将其所含的化学能转变为我们所需要的热能。已知:
①CH4(g)+2O2(g)====CO2(g)+2H2O(l) ΔH=-890.3 kJ·mol-1
②C(s,石墨)+O2(g)====CO2(g) ΔH=-393.5 kJ·mol-1
③2H2(g)+O2(g)====2H2O(l) ΔH=-571.6 kJ·mol-1
标准状况下22.4 L氢气和甲烷的混合气体在足量的氧气中充分燃烧反应放出588.05 kJ的热量,原混合气体中氢气的质量是__________。根据以上三个热化学方程式,计算C(s,石墨)+2H2(g)====CH4(g)的反应热ΔH为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下图为常温下用0.10mol·L-1NaOH溶液滴定20.00 mL 0.10 mol·L-1盐酸和20.00 mL 0.10 mol·L-1醋酸的曲线。若以HA表示酸,下列判断和说法正确的是
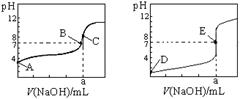
A.左图是滴定盐酸的曲线
B.E点时溶液中离子浓度为c(Na+) = c(A—)
C.B点时,反应消耗溶液体积:V(NaOH)>V(HA)
D.当0mL<V(NaOH)<20. 00mL时,溶液中一定是c(A-)>c(Na+)>c(H+) >c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
已知H—H键键能(断裂时吸收或生成时释放的能量)为436 kJ·mol-1,N—H键键能为391 kJ·mol-1,根据热化学方程式:N2(g)+3H2(g)===2NH3(g) ΔH=-92.4 kJ·mol-1。则N≡N键的键能是( )
A.431 kJ·mol-1 B.945.6 kJ·mol-1
C.649 kJ·mol-1 D.896 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
能用电解原理说明的问题是( )
①电解是把电能转变成化学能 ②电解是化学能转变成电能 ③电解质溶液导电是化学变化,金属导电是物理变化 ④不能自发进行的氧化还原反应,通过电解的原理可以实现 ⑤任何溶液被电解时,必须导致氧化还原反应的发生
A.①②③④ B.②③⑤ C.③④ D.①③④⑤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com