
某消毒液的主要成分为NaCl和NaClO,在空气中易吸收CO2而变质,且NaCl和NaClO在酸性条件下可发生反应:ClO- + Cl- + 2H+ = Cl2↑+ H2O。某学习小组拟探究该消毒液的变质情况。
(1)取适量消毒液放在试管中,加入足量一定浓度的硫酸,有气体放出。通过下列装置检验气体的成分可以判断消毒液是否变质。
学习小组研究后认为变质情况可能有三种:甲:部分变质;乙:未变质;丙: 。
为了验证可能为甲,请完成下列实验方案。限选试剂:
①98%的浓硫酸 ②1%的品红溶液 ③1.0 mol·L-1 的KI-淀粉溶液 ④1.0 mol·L-1 的NaOH溶液 ⑤澄清石灰水 ⑥饱和NaCl溶液

|
所加试剂 |
预期现象和结论 |
|
试管A中加足量 (填序号); 试管B中加1%品红溶液; 试管C中加 (填序号)。 |
若___ ___, 则甲成立。 |
(2)用滴定法测定消毒液中NaClO的浓度(滴定过程涉及的反应有:NaClO + Na2SO3 = NaCl + Na2SO4 ;2KMnO4 + 5Na2SO3+ 3H2SO4 = K2SO4 + 2MnSO4 + 5Na2SO4 + 3H2O)。实验步骤如下:
①量取25.00 mL消毒液放入锥形瓶中,加入过量的a mol·L-1 Na2SO3溶液v1 mL;
②在使用滴定管之前首先进行的操作是____;将b mol·L-1的酸性KMnO4溶液装入 中;滴定,KMnO4和剩余的Na2SO3发生反应。当溶液由无色变成浅红色,且保持半分钟内红色不褪时,停止滴定,记录数据。
③重复滴定操作2次,平均消耗酸性KMnO4溶液v2 mL。则消毒液中NaClO的浓度为 mol·L-1(用含a、b、v1、v2的代数式表示)。
(15分)(1)全部变质(2分);
|
③(2分) ⑤(2分) |
A中溶液变蓝色,B中溶液不褪色, C中溶液变浑浊(2分) |
(2)检查滴定管是否漏液(或检漏)(2分);②酸式(2分);③(av1-5/2bv2)×1/25 (3分)
【解析】
试题分析:(1)变质情况可能有三种:甲:部分变质;乙:未变质;因此第三种情况丙就应该是全部变质。
(2)根据已知的信息可知,要检验是否变质,则需要检验消毒液与硫酸反应生成的气体中是否含有氯气、二氧化碳,据此可以判断消毒液的变质情况。装置A作用是检验氯气,用1.0mol/L的KI淀粉溶液;装置B作用是检验氯气是否除尽;装置C检验二氧化碳,用过量澄清石灰水即可。若A中溶液变蓝色,B中溶液不退色,C中溶液变浑浊,则消毒液部分变质;若A中溶液变蓝色,B中溶液不退色(无变化),C中溶液不变浑浊(无变化),则消毒液未变质;若A中溶液不变蓝色(无变化),B中溶液不退色(无变化),C中溶液变浑浊则消毒液完全变质。
(3)②在使用滴定管之前首先进行的操作是检查滴定管是否漏液(或检漏);酸性KMnO4溶液具有强氧化性,可以腐蚀橡皮管,应装入酸式滴定管中。
③25.00mL消毒液需要酸性KMnO4溶液体积为v2mL,KMnO4的物质的量为v2×10-3L×bmol/L=v2×b×10-3mol。根据反应的方程式可得出关系式5Na2SO3~2KMnO4,据此可知25.00mL溶液未反应n(Na2SO3)=2.5×v2×b×10-3mol。25mL溶液中加入的总的n(Na2SO3)=v1×10-3L×a mol/L=v1×a×10-3mol,参加反应的亚硫酸钠为v1×a×10-3mol-2.5×v2×b×10-3mol=(v1a-2.5 v2b)×10-3mol,根据关系式NaClO~Na2SO3可知,25mL溶液中n(NaClO)=(v1a-2.5 v2b)×10-3mol,所以消毒液中NaClO的浓度为=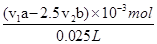 =(av1-5/2bv2)×1/25。
=(av1-5/2bv2)×1/25。
考点:考查物质的检验、仪器的选择、实验方案设计与评价以及物质的量浓度的有关计算等


 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案科目:高中化学 来源: 题型:阅读理解
 (2012?深圳二模)NaCl和NaClO在酸性条件下可发生反应:ClO-+Cl-+2H+=Cl2↑+H2O,某学习小组拟研究消毒液(主要成分为NaCl和NaClO)的变质情况.
(2012?深圳二模)NaCl和NaClO在酸性条件下可发生反应:ClO-+Cl-+2H+=Cl2↑+H2O,某学习小组拟研究消毒液(主要成分为NaCl和NaClO)的变质情况.| 所加试剂 | 预期现象和结论 |
| 试管A中加足量① 1.0mol/LK淀 粉溶液 1.0mol/LK淀 ;粉溶液 试管B中加1%品红溶液; 试管C中加② 澄清石灰水 澄清石灰水 . |
若A中溶液变蓝色,B中溶液不退色,C中溶液变浑浊.则消毒液部分变质; ③ 若A中溶液变蓝色,B中溶液不退色 (无变化),C中溶液不变浑浊(无变化),则 消毒液未变质 若A中溶液变蓝色,B中溶液不退色 则消毒液未变质;(无变化),C中溶液不变浑浊(无变化),则 消毒液未变质 ④ 若A中溶液不变蓝色(无变化),B中溶 液不退色(无变化),C中溶液变浑浊则消 毒液完全变质 若A中溶液不变蓝色(无变化),B中溶 则消毒液完全变质.液不退色(无变化),C中溶液变浑浊则消 毒液完全变质 |
| (2ab-5vc) |
| 50 |
| (2ab-5vc) |
| 50 |
查看答案和解析>>
科目:高中化学 来源: 题型:
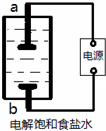 某兴趣小组模拟氯碱工业生产原理并探究其产品的性质.已知文献记载:
某兴趣小组模拟氯碱工业生产原理并探究其产品的性质.已知文献记载:查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
 (2013?资阳二模)某消毒液的主要成分为NaCl和NaClO,在空气中易吸收CO2而变质,且NaCl和NaClO在酸性条件下可发生反应:ClO-+Cl-+2H+=Cl2↑+H2O.某学习小组拟探究该消毒液的变质情况.
(2013?资阳二模)某消毒液的主要成分为NaCl和NaClO,在空气中易吸收CO2而变质,且NaCl和NaClO在酸性条件下可发生反应:ClO-+Cl-+2H+=Cl2↑+H2O.某学习小组拟探究该消毒液的变质情况.| 所加试剂 | 预期现象和结论 |
| 试管A中加足量 ③ ③ (填序号);试管B中加1%品红溶液; 试管C中加 ⑤ ⑤ (填序号). |
若 A中溶液变蓝色,B中溶液不褪色,C中溶液变浑浊 A中溶液变蓝色,B中溶液不褪色,C中溶液变浑浊 ,则甲成立. |
av1-
| ||
| 25 |
av1-
| ||
| 25 |
查看答案和解析>>
科目:高中化学 来源:2012-2013学年江苏省徐州市高三考前模拟化学试卷(解析版) 题型:计算题
某兴趣小组模拟氯碱工业生产原理并探究其产品的性质。已知文献记载:
①氯气与冷的氢氧化钠溶液反应生成NaC1O;氯气与热的氢氧化钠溶液反应可生成NaC1O和NaC1O3。②在酸性较弱时KI只能被NaC1O氧化,在酸性较强时亦能被NaC1O3氧化。
(1)该小组利用如图所示装置制取家用消毒液(主要成分为NaClO),则a为 (填“阳极”或“阴极”)。生成NaClO的离子方程式为 。

(2)该小组将0.784 L(标准状况)Cl2通入50.00 mL热的NaOH溶液中,两者恰好完全反应后,稀释到250.0 mL。
①取稀释后的溶液25.00 mL用醋酸酸化,加入过量KI溶液。用0.2000 mol·L-1 Na2S2O3溶液滴定:I2+2S2O32-=2I-+S4O62-,消耗Na2S2O3溶液10.00 mL时恰好到达终点。
②将上述滴定后的溶液用盐酸酸化至强酸性,再用上述Na2S2O3溶液滴定到终点,需Na2S2O3溶液30.00 mL。
①操作②中氯酸钠与碘化钾反应的离子方程式为 。
②反应后的溶液中次氯酸钠和氯酸钠的物质的量之比为 。
③计算氢氧化钠溶液的物质的量浓度。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com