
在温度相同、容积均为2L的3个恒容密闭容器中,按不同方式投入反应物,保持恒温,测得反应达到平衡时的有关数据如下,下列说法正确的是
(已知N2(g)+3H2(g)=2NH3(g) △H=-92. 4kJ·mol-1)
容器 | 甲 | 乙 | 丙 |
反应物投入量 | 1mol N2、3mol H2 | 2mol N2、6mol H2 | 2mol NH3 |
NH3的浓度( mol·L-1) | c1 | c2 | c3 |
反应的能量变化 | 放出Q1kJ | 放出Q2kJ | 吸收Q3kJ |
体系压强(Pa) | p1 | p2 | p3 |
反应物转化率 | α1 | α2 | α3 |
A.2p1=2p3<p2 B.α2+α3<1
C.达到平衡时乙容器中NH3的体积分数最大 D.Q3+Q1>92.4
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源:2017届江西省高三上学期期中化学试卷(解析版) 题型:推断题
有机物G是一种“β-兴奋剂”,其合成路线如下:

已知:

(1)写出化合物E同时符合下列条件的所有同分异构体有 种。
①红外光谱显示含有三种官能团,其中无氧官能团与E相同,不含甲基
②1H-NMR谱显示分子中含有苯环,且苯环上只有一种不同化学环境的氢原子。
③苯环上只有4个取代基,能发生银镜反应
(2)下列说法不正确的是
A.化合物B生成C的反应为取代反应
B.1mol化合物D最多与4molH2发生加成反应
C.化合物D生成E的条件为浓氯水/铁屑
D.化合物G的分子式为C17H14Cl2NO3
(3)写出E+F→G的化学方程式 。
(4)根据题中信息,设计以苯和CH3COCl为原料制备F的合成路线(用流程图表示,其他无机试剂任选)
查看答案和解析>>
科目:高中化学 来源:2017届江西省高三上学期期中化学试卷(解析版) 题型:选择题
下列实验操作、现象与结论对应关系正确的是
选项 | 操作 | 现象 | 结论 |
A | 将Fe(NO3)2溶于稀H2SO4后,滴加KSCN溶液 | 溶液变成红色 | Fe(NO3)2中一定含Fe3+ |
B | 从煤油中取出一小块钠,用滤纸擦净表面的煤油,放入无水乙醇中 | 产生气泡 | Na能置换出醇烃基中的氢 |
C | 将某气体通入品红溶液 | 溶液褪色 | 气体一定是SO2 |
D | 向NaAlO2溶液中滴入NaHCO3溶液 | 产生白色沉淀 | AlO2-结合H+的能力比HCO3-强 |
查看答案和解析>>
科目:高中化学 来源:2017届江西省高三上学期期中化学试卷(解析版) 题型:选择题
下列有关化学用语表示正确的是
A.对烃基苯甲醛的结构简式:
B.质量数为37的氯原子:1737Cl
C.NH4Br的电子式:
D.二氧化碳分子的比例模型:
查看答案和解析>>
科目:高中化学 来源:2017届江苏省高三上学期月考一化学试卷(解析版) 题型:实验题
CuSO4溶液与K2C2O4溶液棍合反应,产物之一是某种只含一种阴离子的蓝色钾盐水合物。通过下述实验确定该晶体的组成。
步骤a:称取0.6720 g样品,放入锥形瓶,加入适量2 mol·L-1稀硫酸,微热使样品溶解。再加入30 ml水加热,用0.2000 mol·L-1 KMnO4溶液滴定至终点,消耗8.00 mlKMnO4溶液。
步骤b:接着将溶液充分加热,使淡紫红色消失,溶液最终呈现蓝色。冷却后,调节pH并加入过量的KI固体,溶液变为棕色并产生白色沉淀CuI。用0.2500 mol·L-1 Na2S2O3标准溶液滴定至终点,消耗8.00 ml Na2S2O3溶液。已知涉及的部分反应的离子方程式为:
I2+2S2O32-=2I+S4O62-
(1)已知室温下CuI的Ksp=1.27×10-12,欲使溶液中c(Cu )≤1.0×10-6 mol·L-1,应保持溶液中c(I-)≥ mol·L-1。
(2)MnO4-在酸性条件下,加热能分解为O2,同时生成Mn2+。写出该反应的离子方程式为 若无此加热操作,则测定的Cu2+的含量将会 (填“偏高”、“偏低”或“不变”)。
(3)步骤b中第一步反应的方程式为 ,若用淀粉溶液做指示剂,则滴定终点观察到的现象为 。
(4)通过计算确定样品晶体的组成。(请写出计算过程)
查看答案和解析>>
科目:高中化学 来源:2017届江苏省高三上学期月考一化学试卷(解析版) 题型:选择题
化学在绿色发展、循环发展、低碳发展及推进生态文明建设中正发挥着积极作用,一卜列做法与可持续发展宗旨相违背的是
A.加大清洁能源的开发利用,提高资源的利用率
B.推广碳捕集和储存技术,逐步实现二氧化碳零排放
C.加大铅酸蓄电池、含汞锌锰干电池的生产,满足消费需求
D.对工业废水、生活污水净化处理,减少污染物的排放
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
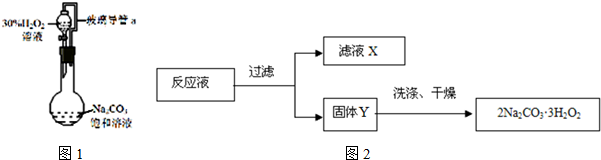
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com