
科目:高中化学 来源:2017届河北省高三上学期摸底考试化学试卷(解析版) 题型:选择题
下列过程中,没有明显实验现象的是( )
A.向Fe(NO3)2溶液中滴加稀硫酸 B.将HCl通入NaAlO2溶液中
C.加热溶有SO2的品红溶液 D、向碳酸氢钠溶液中滴加氢氧化钠溶液
查看答案和解析>>
科目:高中化学 来源:2017届广东省广州市增城区四校高三第一次联考理综化学试卷(解析版) 题型:填空题
(选修二 : 化学与技术)
MgSO4·7H2O在医药上常用做泻药,工业上可用氯碱工业中的一次盐泥为原料生产.已知一次盐泥中含有镁、钙、铁、铝、锰的硅酸盐和碳酸盐等成分.其主要工艺如下:
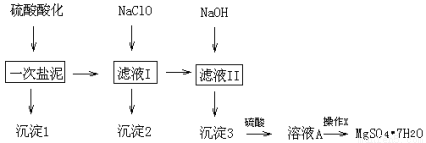
表1:生成氢氧化物沉淀的PH
物质 | 开始沉淀 | 完全沉淀 |
Fe(OH)3 | 2.7 | 3.7 |
Fe(OH)2 | 7.6 | 9.6 |
Mn(OH)2 | 8.3 | 9.8 |
Mg(OH)2 | 9.6 | 11.1 |
Al(OH)3 | 3.7 | 5.7 |
开始溶【解析】 | 完全溶【解析】 |
根据工艺流程和表1,请回答下列问题:
(1)用H2SO4调节溶液PH至1~2,H2SO4作用是
(2)加NaClO溶液至PH=5~6并加热煮沸5~10分钟,沉淀2中主要含有MnO2和另外两种难溶物,这两种难溶物的化学式分别为 ;其中NaClO溶液将MnSO4转化为MnO2的离子方程式为
(3)检验滤液Ⅱ中是否含有Fe3+的实验方法是
(4)“操作X”是将溶液 、过滤洗涤,即得到MgSO4·7H2O晶体.
(5)电解溶液A能否得到单质Mg (填“能”或“不能”),阳极反应式为
(6)准确称量制得的样品5g,用200mL水溶解,加入2mol·L-1的盐酸5mL,在不断搅拌下滴加足量2mol·L-1 BaCl2溶液,充分反应后,得沉淀4.46g,则样品纯度为 .
查看答案和解析>>
科目:高中化学 来源:2017届河北省高三上学期第一次月考化学试卷(解析版) 题型:实验题
硫酸亚铁(FeSO4)加热至高温会分解,生成一种金属氧化物M和两种非金属氧化
物。某化学研究小组利用下列装置加热至高温使FeSO4分解。
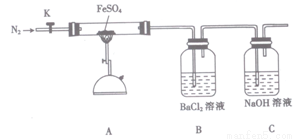
实验步骤:
将一定量FeSO4固体置于硬质玻璃管中,打开活塞K,通人一段时间N2,关闭活塞K。加热A中的玻璃管一段时间,待A中固体不再分解后,停止加热,打开K,缓慢通人氮气至玻璃管冷却。
(2)已知M中铁元素的质量分数为70%,M的化学式为__________。
(2)按图组装好仪器(已省略夹持仪器)并检查装置的气密性,在一定温度下按上述图示装置
进行实验。
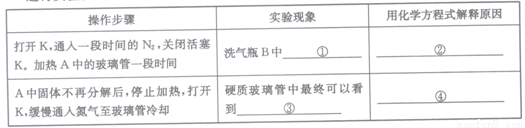
(3)某同学欲验证硫酸亚铁分解产物中含有的另一种非金属氧化物N。
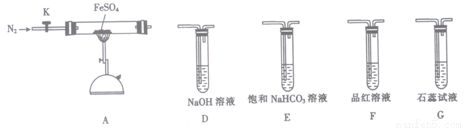
①从实验装置D、E、F、G中,选用两个装置与装置A连接进行实验,依次连接的合理顺序为A →________ →________。
②能证明生成了非金属氧化物N的现象是________________。
查看答案和解析>>
科目:高中化学 来源:2017届河北省高三上学期第一次月考化学试卷(解析版) 题型:选择题
一种制取粗碘的工艺流程如图所示,下列有关说法不正确的是( )
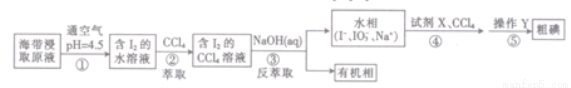
A.步骤②中的萃取过程为物理变化
B.步骤③发生的反应中I2是氧化剂,NaOH是还原剂
C.步骤④所加的试剂X可能是稀硫酸
D.步骤⑤涉及的主要操作Y为分液和蒸馏
查看答案和解析>>
科目:高中化学 来源:2017届陕西省高新部高三上学期一轮复习第一次测试化学试卷(解析版) 题型:推断题
某混合物A,含有KAl(SO4)2、Al2O3和Fe2O3,在一定条件下可实现下图所示的物质之间的变化:

据此回答下列问题:
(1)I、II、III、IV四步中对于溶液和沉淀的分离采取的方法是 ,所用玻璃仪器有哪些
(2)根据上述框图反应关系,写出下列B、C、D、E所含物质的化学式沉淀固体B ;沉淀D ;溶液E 。
(3)写出①、②、③、④四个反应方程式,离子反应写离子方程式。
① ;
② ;
③ ;
④ 。
查看答案和解析>>
科目:高中化学 来源:2017届陕西省高新部高三上学期一轮复习第一次测试化学试卷(解析版) 题型:选择题
如图是模拟“侯氏制碱法”制取NaHCO3的部分装置。下列操作正确的是( )

A.a通入CO2,然后b通入NH3,c中放碱石灰
B.b通入NH3然后a通入CO2,c中放碱石灰
C.b通入CO2,然后a通入NH3,c中放蘸稀硫酸的脱脂棉
D.a通入NH3,然后b通入CO2,c中放蘸稀硫酸的脱脂棉
查看答案和解析>>
科目:高中化学 来源:2017届辽宁省葫芦岛市六校协作体高三上期初考试化学试卷(解析版) 题型:实验题
锰的化合物种类较多,也大多具有广泛的用途。
I. MnO2是H2O2分解的良好的催化剂,它也具有较强的氧化性。某化学兴趣小组通过实验探究MnO2的性质。
(1)该小组设计了如下4个方案以验证MnO2的氧化性,可行的是____________。
A.把MnO2固体加入到稀盐酸中,观察是否有黄绿色气体生成
B.把MnO2固体加入到H2O2溶液中,观察是否有气泡产生
C.Na2SO3溶液中,加入MnO2固体,再滴加BaCl2溶液,观察是否有白色沉淀生成
D.FeSO4溶液中滴加几滴KSCN溶液,再加入MnO2固体,观察溶液是否变红
(2)为研究溶液中MnO2的氧化能力与溶液酸碱性的关系,该小组同学设计了如下的对比实验:在室温下,取A、B、C三支试管,用同浓度同体积的KI溶液和质量、颗粒大小相同的MnO2固体反应,然后分别加入1mL 0.2mol/L NaOH溶液、1mL水、1mL 0.1mol/L硫酸。现象记录如下:

①从以上实验中,我们可以得出的结论是_________________________________。
②写出C试管中发生反应的离子方程式:_________________________________。
Ⅱ,铁酸锰( MnFe2O4)可用于热化学循环分解水制氢,可有效缓解能源危机。MnFe2O4的制备工艺流程如下图:
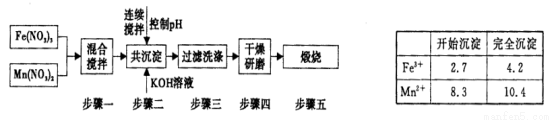
已知Fe3+、Mn2+沉淀的pH为上表所示。
①步骤一中投入原料Fe(NO3)3和Mn(NO3)2的物质的量之比理论上应为_____________________。
②步骤二中需控制pH的范围是 ___________ 。
③步骤三中是否洗涤干净的判断方法是 _______________ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com