
【题目】氮的氧化物是造成大气污染的主要物质。研究氮氧化物的反应机理对于消除环境污染有重要意义。
(1)NO在空气中存在如下反应:2NO(g)+O2(g)2NO2(g)△H,上述反应分两步完成,其反应历程如图1所示, 回答下列问题:
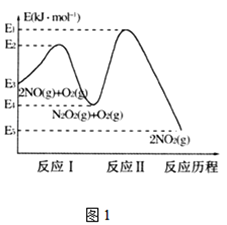
①写出反应I的热化学方程式________________。
②反应I和反应Ⅱ中,一个是快反应,会快速建立平衡状态,而另一个是慢反应。决定2NO(g)+O2(g)![]() 2NO2(g)反应速率的是___(填“反应I”或“反应Ⅱ”);对该反应体系升高温度,发现总反应速率反而变慢,其原因可能是_____________(反应未使用催化剂)。
2NO2(g)反应速率的是___(填“反应I”或“反应Ⅱ”);对该反应体系升高温度,发现总反应速率反而变慢,其原因可能是_____________(反应未使用催化剂)。
(2)用活性炭还原法也可处理氮氧化物。有关反应为:2C(s)+2NO2(g)![]() N2(g)+2CO2(g),起始时向密闭容器中充入一定量的C(s)和NO2(g),在不同条件下,测得各物质的浓度变化状况如下图所示。
N2(g)+2CO2(g),起始时向密闭容器中充入一定量的C(s)和NO2(g),在不同条件下,测得各物质的浓度变化状况如下图所示。

①0~10min,1020 min,3040 min三个阶段NO2的转化率分别为α1、α2、α3,其中最小的为_________,其值是___________________。
②计算反应达到第一次平衡时的平衡常数K=____________。
③第10min时,若只改变了影响反应的一个条件,则改变的条件为______(填选项字母)。
A.增加C(s)的量 B.减小容器体积 C.加入催化剂
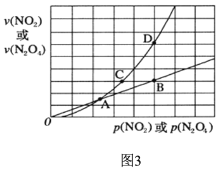
(3)NO2存在如下平衡:2NO2(g)![]() N2O4(g)△H<0,在图3标出点中,指出能表示反应达到平衡状态的点是________,理由是________________。
N2O4(g)△H<0,在图3标出点中,指出能表示反应达到平衡状态的点是________,理由是________________。
【答案】2NO(g) = N2O2(g) △H=(E4-E3) kJ·mol1 反应Ⅱ 温度升高后反应I平衡逆向移动,导致N2O2浓度减小,温度升高对反应Ⅱ的影响弱于N2O2浓度减小的影响,导致反应Ⅱ速度变慢,最终总反应速率变慢 α1 20% 0.675 C B、D 达到平衡时,N2O4与NO2的消耗速率满足条件υ(NO2) = 2(N2O4)
【解析】
(1)①反应热焓变等于生成物总能量减去反应物总能量,因此反应I的热化学方程式2NO(g) = N2O2(g) △H=(E4-E3) kJ·mol1;故答案为:2NO(g) = N2O2(g) △H=(E4-E3) kJ·mol1。
②反应I和反应Ⅱ中,反应Ⅱ所需活化能大,反应速率慢,慢反应决定反应体系速率,因此决定2NO(g) + O2(g) ![]() 2NO2(g)反应速率的是反应Ⅱ;对该反应体系升高温度,发现总反应速率反而变慢,其原因可能是温度升高后反应I平衡逆向移动,导致N2O2浓度减小,温度升高对反应Ⅱ的影响弱于N2O2浓度减小的影响,导致反应Ⅱ速度变慢,最终总反应速率变慢;故答案为:反应Ⅱ;温度升高后反应I平衡逆向移动,导致N2O2浓度减小,温度升高对反应Ⅱ的影响弱于N2O2浓度减小的影响,导致反应Ⅱ速度变慢,最终总反应速率变慢。
2NO2(g)反应速率的是反应Ⅱ;对该反应体系升高温度,发现总反应速率反而变慢,其原因可能是温度升高后反应I平衡逆向移动,导致N2O2浓度减小,温度升高对反应Ⅱ的影响弱于N2O2浓度减小的影响,导致反应Ⅱ速度变慢,最终总反应速率变慢;故答案为:反应Ⅱ;温度升高后反应I平衡逆向移动,导致N2O2浓度减小,温度升高对反应Ⅱ的影响弱于N2O2浓度减小的影响,导致反应Ⅱ速度变慢,最终总反应速率变慢。
(2)①0~10min,1020 min,3040 min三个阶段NO2的转化率分别为![]() 、
、![]() 、
、![]() ,其中最小的为α1,其值是20%。
,其中最小的为α1,其值是20%。
②根据图中信息计算反应达到第一次平衡时的平衡常数![]() ;故答案为:0.675。
;故答案为:0.675。
③根据图中信息,第10min时,反应速率加快,若只改变了影响反应的一个条件,A.增加C(s)的量,速率不变,故A不符合题意;B.减小容器体积,浓度瞬间增大,但图中信息浓度没有变化,故B不符合题意;C.加入催化剂,速率加快,故C符合题意;综上所述,答案为C。
(3)NO2存在如下平衡:2NO2(g)![]() N2O4(g) △H<0,根据图3标出点信息,当达到平衡时,υ(NO2) = 2(N2O4),则BD两点满足;故答案为:B、D;达到平衡时,N2O4与NO2的消耗速率满足条件υ(NO2) = 2(N2O4)。
N2O4(g) △H<0,根据图3标出点信息,当达到平衡时,υ(NO2) = 2(N2O4),则BD两点满足;故答案为:B、D;达到平衡时,N2O4与NO2的消耗速率满足条件υ(NO2) = 2(N2O4)。


 53随堂测系列答案
53随堂测系列答案科目:高中化学 来源: 题型:
【题目】有机物![]() 只含有
只含有![]() 、
、![]() 、
、![]() 三种元素,常用作有机合成的中间体。
三种元素,常用作有机合成的中间体。![]() 该有机物在足量
该有机物在足量![]() 中充分燃烧生成
中充分燃烧生成![]()
![]() 和
和![]()
![]() ,质谱图表明其相对分子质量为84,分析其红外光谱图可知
,质谱图表明其相对分子质量为84,分析其红外光谱图可知![]() 分子中含有
分子中含有![]() 键和位于端点处的
键和位于端点处的![]() 键,核磁共振氢谱上有三组峰,峰面积之比为
键,核磁共振氢谱上有三组峰,峰面积之比为![]() 。
。
(1)![]() 的分子式是______。
的分子式是______。
(2)![]() 的结构简式是______。
的结构简式是______。
(3)下列物质中,一定条件下能与![]() 发生反应的是______(填序号)。
发生反应的是______(填序号)。
A.![]() B.
B.![]()
C.酸性![]() 溶液 D.
溶液 D.![]() 的
的![]() 溶液
溶液
(4)有机物![]() 是
是![]() 的同分异构体,
的同分异构体,![]()
![]() 最多可与
最多可与![]()
![]() 完全加成。已知
完全加成。已知![]() 中所有碳原子在同一个平面上,且没有顺反异构现象,则
中所有碳原子在同一个平面上,且没有顺反异构现象,则![]() 的结构简式为______。
的结构简式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】质谱图显示,某化合物的相对分子质量为74;燃烧实验发现,该化合物分子内碳、氢原子个数之比为2∶5;核磁共振氢谱显示,该化合物分子中只有两种类型的氢原子。下列关于该化合物的叙述不正确的是( )
A.该化合物可能为![]() 甲基
甲基![]() 丙醇B.该化合物为
丙醇B.该化合物为![]() 丁醇的同分异构体
丁醇的同分异构体
C.该化合物可能为乙醚D.该化合物为乙醚的同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下是我国化学家近年来合成的聚乙炔衍生物分子M的结构简式及M在稀硫酸作用下的水解过程。下列有关说法不正确的是( )

A.M与A均能使酸性高锰酸钾溶液和溴水退色
B.B中含有羧基和羟基两种官能团,B能发生消去反应和酯化反应
C.![]() 与热的烧碱溶液反应,最多可消耗
与热的烧碱溶液反应,最多可消耗![]()
D.A、B、C各![]() 分别与足量金属钠反应,放出的气体的物质的量之比为1∶2∶2
分别与足量金属钠反应,放出的气体的物质的量之比为1∶2∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表中各组物质之间不能通过一步反应实现如图转化的是

甲 | 乙 | 丙 | |
A | CH2=CH2 | CH3CH2Cl | CH3CH2OH |
B | NH3 | NO | HNO3 |
C | AlCl3 | Al(OH)3 | Al2O3 |
D | Cl2 | HCl | CuCl2 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】探究Na2O2与水的反应,实验如图:
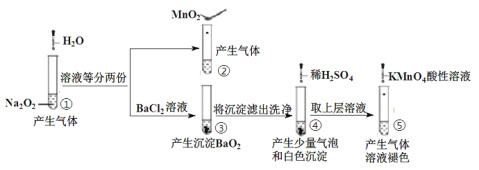
已知:H2O2H++HO2-;HO2-H++O22-
下列分析不正确的是
A.①、④实验中均发生了氧化还原反应和复分解反应
B.①、⑤中产生的气体能使带火星的木条复燃,说明存在H2O2
C.③和④不能说明溶解性:BaO2>BaSO4
D.⑤中说明H2O2具有还原性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学结合所学知识探究Na2O2与H2能否反应,设计装置如图,下列说法正确的是( )

A.装置A中锌粒可用铁粉代替
B.装置B中盛放碱石灰,目的是除去A中挥发出来的少量水蒸气
C.装置C加热前,必须先用试管在干燥管管口处收集气体,检验气体纯度
D.装置A也可直接用于MnO2与浓盐酸反应制取Cl2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】滴定实验是化学学科中重要的定量实验。请回答下列问题:
I.酸碱中和滴定——用标准盐酸滴定未知浓度的NaOH溶液。
(1)该学生的实验操作如下:
a.用碱式滴定管取稀NaOH25.00mL,注入锥形瓶中,加入甲基橙做指示剂。
b.用待测定的溶液润洗碱式滴定管。
c.用蒸馏水洗干净滴定管。
d.取下酸式滴定管用标准的HCl溶液润洗后,将标准液注入滴定管刻度“0”以上2~3cm处,再把滴定管固定好,调节液面至刻度“0”或“0”刻度以下。
e.检查滴定管是否漏水。
f.另取锥形瓶,再重复操作一次。
g.把锥形瓶放在滴定管下面,瓶下垫一张白纸,边滴边摇动锥形瓶直至滴定终点,记下滴定管液面所在刻度。
①滴定操作的正确顺序是(用序号填写)__→c→__→__→d→__→___。
②某次滴定前、后的盛放盐酸滴定管中液面的位置。请回答:
仪器A的名称是__;盐酸的体积读数:滴定前读数为__mL,滴定后读数为____mL;

③在G操作中如何确定终点___。
(2)下列操作造成测定结果偏高的是___(填选项字母)
A.滴定终点时,俯视滴定管溶液液面
B.盛装未知液的锥形瓶用蒸馏水洗过,未用未知液润洗
C.酸式滴定管用蒸馏水洗净后,未用标准盐酸润洗
D.滴定前,滴定管尖嘴有气泡,滴定后气泡消失
II.氧化还原滴定—取草酸溶液置于锥形瓶中,加入适量稀硫酸,用浓度为0.1mol/L的高锰酸钾溶液滴定,发生的反应为:2KMnO4+5H2C2O4+3H2SO4=K2SO4+10CO2↑+2MnSO4+8H2O。表格中记录了实验数据:
滴定次数 | 待测液体积(mL) | 标准KMnO4溶液体积(mL) | |
滴定前读数 | 滴定后读数 | ||
第一次 | 25.00 | 0.50 | 20.40 |
第二次 | 25.00 | 3.00 | 23.00 |
第三次 | 25.00 | 4.00 | 24.10 |
(1)滴定时,KMnO4溶液应装在___(“酸”或“碱”)式滴定管中,滴定终点时滴定现象是___。
(2)该草酸溶液的物质的量浓度为___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com