
| A. | 将少量醋酸加入NaAlO2溶液中:CH3COOH+AlO${\;}_{2}^{-}$+H2═CH3COO-+Al(OH)3↓ | |
| B. | 将钠粒投入CuSO4溶液中:2Na+Cu2+═Cu+2Na+ | |
| C. | 将NaHSO4溶液滴加到含有酚酞的Ba(OH)2溶液中,溶液由红色变成无色:Ba2++OH-+H++SO${\;}_{4}^{2-}$═BaSO4↓+H2O | |
| D. | 硫化钠溶液中加入少量的氯化铁溶液:S2-+Fe3+═Fe2++S↓ |
分析 A.醋酸少量反应生成醋酸钠和氢氧化铝;
B.钠与硫酸铜溶液反应生成氢氧化铜沉淀、硫酸钠和氢气;
C.当溶液的颜色刚好由红色变为无色时,n(H+)=n(OH-),二者按照物质的量之比为2:1反应;
D.电荷不守恒.
解答 解:A.醋酸少量反应生成醋酸钠和氢氧化铝,离子方程式:CH3COOH+AlO2-+H2O═CH3COO-+Al(OH)3↓,故A正确;
B.将钠粒投入CuSO4溶液中,离子方程式:2Na+2H2O+Cu2+=Cu(OH)2↓+2Na++H2↑,故B错误;
C.当溶液的颜色刚好由红色变为无色时,n(H+)=n(OH-),可假设Ba(OH)2为1mol,即Ba2+为1mol,OH-为2mol,需要2molNaHSO4,反应的离子方程式为2H++SO42-+Ba2++2OH-═BaSO4↓+2H2O,故C错误;
D.硫化钠溶液中加入少量的氯化铁溶液:S2-+2Fe3+═2Fe2++S↓,故D错误.
故选:A.
点评 本题考查离子方程式的书写和注意问题,明确反应的实质是解题关键,注意三价铁离子和硫离子发生氧化还原反应,题目难度不大.


 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1molNH3中含有6.02×1024个电子 | |
| B. | 1mol水中含有2mol氢和1mol氧 | |
| C. | 1molOH-中含有8mol中子 | |
| D. | 2.3g钠由原子变成离子时,失去的电子数为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NO2 | B. | N2 | C. | SO2 | D. | NH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
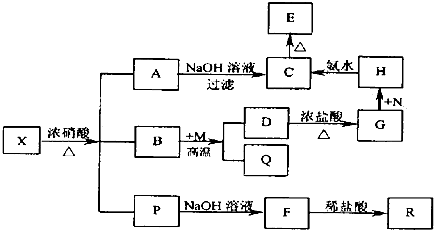
 水合肼作为一种重要的精细化工原料,在农药、医药及有机合成中有广泛用途.用尿素法制水合肼,可分为两个阶段,第一阶段为低温氯化阶段,第二阶段为高温水解阶段,总反应方程式为:CO (NH2)2+NaClO+2NaOH→H2N-NH2•H2O+NaCl+Na2CO3.
水合肼作为一种重要的精细化工原料,在农药、医药及有机合成中有广泛用途.用尿素法制水合肼,可分为两个阶段,第一阶段为低温氯化阶段,第二阶段为高温水解阶段,总反应方程式为:CO (NH2)2+NaClO+2NaOH→H2N-NH2•H2O+NaCl+Na2CO3.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NA 个氨气分子中含有3mol σ 键 | |
| B. | 18g水中含有NA 对孤电子对 | |
| C. | NA 个氮气分子中含有2mol π键 | |
| D. | NA 个二氧化碳分子中含有2mol π键 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com