
| n(K+) | ||
n(
|


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、放电时,正极发生氧化反应 |
| B、放电时,把热能转化为电能 |
| C、充电时,电池的负极发生还原反应 |
| D、充电时,把化学能转化为电能 |
查看答案和解析>>
科目:高中化学 来源: 题型:
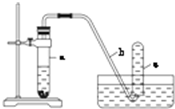 用如图所示的装置进行实验:
用如图所示的装置进行实验:查看答案和解析>>
科目:高中化学 来源: 题型:
 如图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:(1)该浓盐酸中HCl的物质的量浓度为
如图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:(1)该浓盐酸中HCl的物质的量浓度为查看答案和解析>>
科目:高中化学 来源: 题型:
| 催化剂 |
| 加热 |
| 实验序号 | 温度℃ | 初始CCl4浓度(mol?L-1) | 初始H2浓度(mol?L-1) | CCl4的转化率 |
| 1 | 110 | 0.8 | 1.2 | A |
| 2 | 110 | 1 | 1 | 50% |
| 3 | 100 | 1 | 1 | B |
查看答案和解析>>
科目:高中化学 来源: 题型:
 一定条件下,在容积为1L的密闭容器中发生可逆反应:Fe(s)+H2O(g)═FeO(s)+H2(g)△H>0.在1000℃时,H2O(g)的平衡转化率(α)与体系总压强(p)关系如图所示.
一定条件下,在容积为1L的密闭容器中发生可逆反应:Fe(s)+H2O(g)═FeO(s)+H2(g)△H>0.在1000℃时,H2O(g)的平衡转化率(α)与体系总压强(p)关系如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:
| 阳离子 | K+,Ba2+Fe2+Al3+ Fe3+ Mg2+ | ||||
| 阴离子 | OH-HCO
|
- 3 |
2- 3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com