
分析 (1)盖斯定律的内容为:化学反应的反应热值与反应的始态和终态有关,而与反应进行的途径无关,根据盖斯定律,用第一个热化学方程式减去第二个热化学方程式可得焦炭与水蒸气反应的热化学方程式;
(2)氯化银难溶于水,在水中的溶解度很小,一定温度下,溶液中Ksp(AgCl)=c(Ag+)•c(Cl-)为定值,溶液中c(Cl-)越大,c(Ag+)越小;
(3)根据反应Fe(OH)3+3H+?Fe3++3H2O的平衡常数K=$\frac{c(F{e}^{3+})}{{c}^{3}({H}^{+})}$=$\frac{c(F{e}^{3+})}{{c}^{3}({H}^{+})}$×$\frac{{c}^{3}(O{H}^{-})}{{c}^{3}(O{H}^{-})}$=$\frac{Ksp(Fe(OH)_{3})}{Kw}$计算;
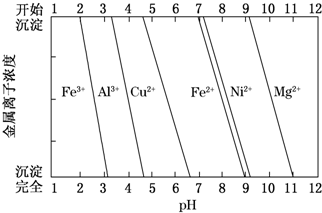
(4)②+2价铁会氧化为+3价铁,会在3.4前出现沉淀,pH=3.4时开始出现沉淀为Al(OH)3,pH=8.0时过滤沉淀为Ni(OH)2,因此该铜合金中还含Al、Ni;
解答 解:(1)已知:①H2(g)+$\frac{1}{2}$O2(g)═H2O(g);△H=-241.81kJ•mol-1,
②C(s)+$\frac{1}{2}$O2(g)═CO(g);△H=-110.51kJ•mol-1,
利用盖斯定律,将②-①可得:C(s)+H2O(g)=CO(g)+H2(g),△H=(-110.5kJ/mol)-(-241.8kJ/mol)=+13l.3 kJ/mol,
所以焦炭与水蒸气反应的热化学方程式为:C(s)+H2O(g)═CO(g)+H2(g);△H=+13l.3kJ•mol-1,
故答案为:C(s)+H2O(g)═CO(g)+H2(g);△H=+13l.3kJ•mol-1.
(2)氯化银难溶于水,在水中的溶解度很小,一定温度下,溶液中Ksp(AgCl)=c(Ag+)•c(Cl-)为定值,①蒸馏水中没有氯离子、②0.1mol/L盐酸中c(Cl-)=0.1mol/L,③0.1 mol/L氯化镁溶液c(Cl-)=0.2mol/L、④0.1mol/L硝酸银溶液中c(Ag+)=0.1mol/L,溶液中c(Ag+)为④>①>②>③,
故答案为:④>①>②>③;
(3)已知25℃时,Ksp[Fe(OH)3]=2.79×10-39,Fe(OH)3+3H+?Fe3++3H2O的平衡常数K=$\frac{c(F{e}^{3+})}{{c}^{3}({H}^{+})}$=$\frac{c(F{e}^{3+})}{{c}^{3}({H}^{+})}$×$\frac{{c}^{3}(O{H}^{-})}{{c}^{3}(O{H}^{-})}$=$\frac{Ksp(Fe(OH)_{3})}{(Kw)^{3}}$=$\frac{2.79×1{0}^{-39}}{(1{0}^{-14})^{3}}$=2.79×103,
故答案为:2.79×103;
(4)+2价铁会氧化为+3价铁,会在3.4前出现沉淀,由图可知,结合题中信息可知开始出现沉淀为Al(OH)3、pH=8.0时过滤沉淀Ni(OH)2,因此该铜合金中还含Al、Ni,
故答案为:Al、Ni;
点评 本题考查了热化学方程式的书写、盖斯定律的应用,强弱电解质、弱电解质的电离、盐类水解、溶度积及相关计算,难溶物溶解平衡及其应用,题目难度中等,注意掌握溶度积和离子积常数的计算方法.


 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3:2 | B. | 1:3 | C. | 2:3 | D. | 1:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 纯净物 | 混合物 | 强电解质 | 弱电解质 | 非电解质 | |
| A | 盐酸 | 漂白粉 | 硫酸 | 醋酸 | 干冰 |
| B | 氢氧化钡 | 蔗糖溶液 | 氯化银 | 溴水 | 二氧化硫 |
| C | 胆矾 | 石灰水 | 氧化铝 | 水 | 氯气 |
| D | 小苏打 | 氢氧化 铁胶体 | 胆矾 | 次氯酸 | 酒精 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| Fe3+ | Fe2+ | Zn2+ | |
| 开始沉淀的pH | 1.1 | 5.8 | 5.9 |
| s沉淀完全的pH | 3.0 | 8.8 | 8.9 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | BaSO4难溶于水,在水中离子浓度很小,所以BaSO4是弱电解质 | |
| B. | 在水溶液中能导电的化合物就是电解质 | |
| C. | H2SO4在电流作用下在水中电离出H+和SO42- | |
| D. | 液态HCl,固态NaCl均不导电,但HCl、NaCl是电解质 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com