
| A����ϵѹǿ���ֲ��� | B�����������ɫ���ֲ��� |
| C��SO3��NO������ȱ��ֲ��� | D��ÿ���� 1 mol SO2��ͬʱ����1 mol NO |
 CH3OH(g)
CH3OH(g)  ) ��4��1��7
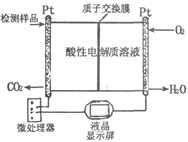
) ��4��1��7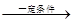 CH3OH(g)����2�����ͨ��״��ĵ缫Ϊ�������缫��ӦΪ��2CH3OH-12e-+2H2O=2CO2+12H+���ұ�ͨ��O2�ĵ缫Ϊ���������������Խ��ʣ������ĵ缫��ӦΪ��3O2+12e-+12H+=6H2O����3��NO2��SO2��Ӧ����SO3��g����NO�ķ���ʽΪ��NO2+SO2
CH3OH(g)����2�����ͨ��״��ĵ缫Ϊ�������缫��ӦΪ��2CH3OH-12e-+2H2O=2CO2+12H+���ұ�ͨ��O2�ĵ缫Ϊ���������������Խ��ʣ������ĵ缫��ӦΪ��3O2+12e-+12H+=6H2O����3��NO2��SO2��Ӧ����SO3��g����NO�ķ���ʽΪ��NO2+SO2 SO3(g)+NO��A���÷�Ӧ�Ƿ�Ӧǰ�����������ȵĿ��淴Ӧ���������۷�Ӧ�Ƿ�ﵽƽ�⣬��Ӧ��ѹǿ�����ᷢ���仯��B�������������ݻ����䣬����Ӧ�ﵽƽ�⣬�κ����ʵ����ʵ������䣬NO2����ɫ�����ʣ���Ũ�Ȳ��䣬���Ի��������ɫ���ֲ��䡣��˸÷�Ӧ�ﵽƽ�⡣��ȷ��C��������ӦNO2+SO2
SO3(g)+NO��A���÷�Ӧ�Ƿ�Ӧǰ�����������ȵĿ��淴Ӧ���������۷�Ӧ�Ƿ�ﵽƽ�⣬��Ӧ��ѹǿ�����ᷢ���仯��B�������������ݻ����䣬����Ӧ�ﵽƽ�⣬�κ����ʵ����ʵ������䣬NO2����ɫ�����ʣ���Ũ�Ȳ��䣬���Ի��������ɫ���ֲ��䡣��˸÷�Ӧ�ﵽƽ�⡣��ȷ��C��������ӦNO2+SO2 SO3(g)+NO ��ÿ����SO31mol,��Ȼͬʱ����NO1mol��������۷�Ӧ�Ƿ�ﵽƽ�⣬SO3��NO�������ʼ�ձ��ֲ��䡣�ʲ�����Ϊ��Ӧ�ﵽƽ��ı�־������D��SO2�Ƿ�Ӧ�NOΪ���������ʽ�ж��ߵ����ʵ����ı�Ϊ1:1,����ÿ���� 1 mol SO2��ͬʱ����1 mol NO ���뷴Ӧ�Ƿ�ﵽƽ���أ���˲�����Ϊ��Ӧ�ﵽƽ��ı�־�������跴Ӧ��ʼʱ��n(NO2)="amol;" n(SO2)=2amol�����ڷ�Ӧ������?n(NO2)="xmol" ����?n(SO2)=xmol,��ﵽƽ���Ƿ�ӦNO2+SO2
SO3(g)+NO ��ÿ����SO31mol,��Ȼͬʱ����NO1mol��������۷�Ӧ�Ƿ�ﵽƽ�⣬SO3��NO�������ʼ�ձ��ֲ��䡣�ʲ�����Ϊ��Ӧ�ﵽƽ��ı�־������D��SO2�Ƿ�Ӧ�NOΪ���������ʽ�ж��ߵ����ʵ����ı�Ϊ1:1,����ÿ���� 1 mol SO2��ͬʱ����1 mol NO ���뷴Ӧ�Ƿ�ﵽƽ���أ���˲�����Ϊ��Ӧ�ﵽƽ��ı�־�������跴Ӧ��ʼʱ��n(NO2)="amol;" n(SO2)=2amol�����ڷ�Ӧ������?n(NO2)="xmol" ����?n(SO2)=xmol,��ﵽƽ���Ƿ�ӦNO2+SO2 SO3(g)+NOƽ����ϵ��n(NO2)=(a-x)mol;n(SO2)=(2a-x)mol;n(SO3)=xmol;n(NO)=xmol������ƽ��ʱNO2��SO2�����Ϊ1:6������(a-x)��(2a-x)=1:6�����
SO3(g)+NOƽ����ϵ��n(NO2)=(a-x)mol;n(SO2)=(2a-x)mol;n(SO3)=xmol;n(NO)=xmol������ƽ��ʱNO2��SO2�����Ϊ1:6������(a-x)��(2a-x)=1:6����� �������ڸ��¶��¸÷�Ӧƽ�ⳣ��
�������ڸ��¶��¸÷�Ӧƽ�ⳣ�� ����4���ɷ���ʽ���Կ�����ÿ����1mol��CO2�����Ļ������2mol�����ڲ���2��24L��־״���µ�CO2��������0��1 mol CO2��������������0��1mol�������������Ħ������Ϊ44g/mol������NOΪxmol, NO2Ϊ(1-x)mol��30x+46(1-x)=44����x:(1-x)=1:7��
����4���ɷ���ʽ���Կ�����ÿ����1mol��CO2�����Ļ������2mol�����ڲ���2��24L��־״���µ�CO2��������0��1 mol CO2��������������0��1mol�������������Ħ������Ϊ44g/mol������NOΪxmol, NO2Ϊ(1-x)mol��30x+46(1-x)=44����x:(1-x)=1:7��


| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 CH3OH��g��+ H2O��g�� ��H<0��CH3OH��Ũ����ʱ��仯��ͼ���ش��й����⣺
CH3OH��g��+ H2O��g�� ��H<0��CH3OH��Ũ����ʱ��仯��ͼ���ش��й����⣺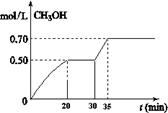
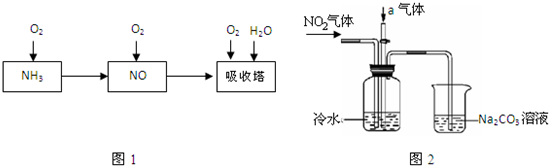
 Na2S4 + 3NaBr���øõ��Ϊ��Դ������������ˮ��Һ������ʽ��е�⣬ʹCO2��ͭ�缫�Ͽ�ת��Ϊ���顣
Na2S4 + 3NaBr���øõ��Ϊ��Դ������������ˮ��Һ������ʽ��е�⣬ʹCO2��ͭ�缫�Ͽ�ת��Ϊ���顣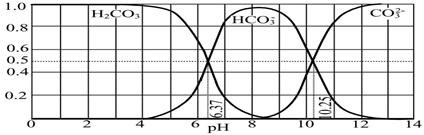
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ��ʴ���
 N2O4��g����ƽ�ⳣ��K= ����NO2��ʼŨ��Ϊ2mol/L����ͬ�����£�NO2�����ת����Ϊ ��
N2O4��g����ƽ�ⳣ��K= ����NO2��ʼŨ��Ϊ2mol/L����ͬ�����£�NO2�����ת����Ϊ ���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
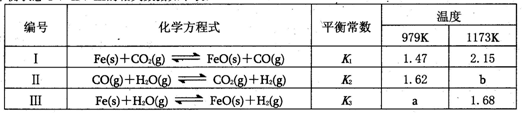
| A��a>b |
| B�������¶�ƽ��״̬��������Ӧ�����ƶ� |
| C������ѹǿ��ƽ��״̬II���ƶ� |
| D����ӦII�����Ϊ���ȷ�Ӧ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
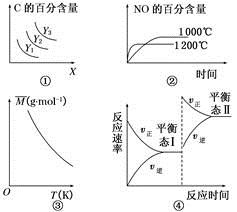
 3C(g)����H>0����ƽ��ʱC�İٷֺ���������X��Y�Ĺ�ϵ��ͼ����ʾ����Y���ܱ�ʾ�¶ȣ�X���ܱ�ʾѹǿ����Y3>Y2>Y1
3C(g)����H>0����ƽ��ʱC�İٷֺ���������X��Y�Ĺ�ϵ��ͼ����ʾ����Y���ܱ�ʾ�¶ȣ�X���ܱ�ʾѹǿ����Y3>Y2>Y1 4NO(g)��6H2O(g)����H����1 025 kJ��mol��1������Ӧ����ʼ���ʵ�����ͬ����ͼ�ڿɱ�ʾ�¶ȶ�NO�İٷֺ�����Ӱ��
4NO(g)��6H2O(g)����H����1 025 kJ��mol��1������Ӧ����ʼ���ʵ�����ͬ����ͼ�ڿɱ�ʾ�¶ȶ�NO�İٷֺ�����Ӱ�� B(��)��2C(��)��Q(Q>0)��������ͼ����ʾ�Ĺ�ϵ����B��C���ܾ�Ϊ����
B(��)��2C(��)��Q(Q>0)��������ͼ����ʾ�Ĺ�ϵ����B��C���ܾ�Ϊ�����鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 2NO(g)��O2(g)������̶����ܱ������з�Ӧ���ﵽƽ��״̬�ı�־�� (����)
2NO(g)��O2(g)������̶����ܱ������з�Ӧ���ﵽƽ��״̬�ı�־�� (����)| A���٢ܢݢ� | B���٢ڢۢ� | C���ڢۢܢ� | D������ȫ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
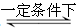 2SO3�������������Ҫ��Ӧ�����й��ڸ÷�Ӧ��˵����ȷ����
2SO3�������������Ҫ��Ӧ�����й��ڸ÷�Ӧ��˵����ȷ����| A��ʹ�ô�����Ӱ�췴Ӧ���� |
| B��������ϵ�¶��ܼӿ췴Ӧ���� |
| C������O2��Ũ���ܼӿ췴Ӧ���� |
| D��һ�������´ﵽ��Ӧ��ʱSO2ȫ��ת��ΪSO3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 xC(g)+2D(g)����4min����D��Ũ��Ϊ0��5mol/L��c(A)��c(B)=3��5����C��ʾ��ƽ������v��C��=0��125mol��L-1��min-1������˵����ȷ����
xC(g)+2D(g)����4min����D��Ũ��Ϊ0��5mol/L��c(A)��c(B)=3��5����C��ʾ��ƽ������v��C��=0��125mol��L-1��min-1������˵����ȷ�����鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A����λʱ��������n mol A2��ͬʱ����n mol AB |
| B�������ڵ���ѹǿ����ʱ��ı仯���仯 |
| C����λʱ��������2n mol AB��ͬʱ����n mol B2 |
| D����λʱ��������n mol A2��ͬʱ����n mol B2 |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com