
| A、金刚石、石墨 |
| B、红磷、白磷 |
| C、二氧化硫和三氧化硫 |
| D、斜方硫、单斜硫 |


科目:高中化学 来源: 题型:
| A、1:1 | B、1:2 |
| C、1:3 | D、1:4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、
| ||
B、
| ||
| C、(A-N+2)mol | ||
D、
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①② | B、②③ | C、③④ | D、②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
 利用如图装置测定中和热的实验步骤如下:
利用如图装置测定中和热的实验步骤如下:| 温度 实验次数 | 起始温 度t1℃ | 终止温度t2/℃ | 温度差平均值(t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 29.5 | |
| 2 | 27.0 | 27.4 | 27.2 | 32.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.2 | |
| 4 | 26.4 | 26.2 | 26.3 | 29.8 | |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
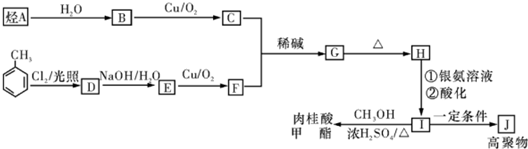
科目:高中化学 来源: 题型:
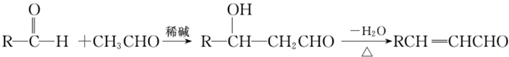
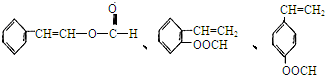 、
、查看答案和解析>>
科目:高中化学 来源: 题型:
 +CH3COOH
+CH3COOH| △ |
 +H2O
+H2O| 名称 | 式量 | 性状 | 密度/g/cm3 | 沸点/℃ | 溶解度 | |
| 苯 胺 | 93 | 无色油状液体, 具有还原性 | 1.02 | 184.4 | 微溶于水 | 易溶于乙醇、乙醚等 |
| 乙 酸 | 60 | 无色液体 | 1.05 | 118.1 | 易溶于水 | 易溶于乙醇、乙醚 |
| 乙酰苯胺 | 135 | 白色晶体 | 1.22 | 304 | 微溶于冷水, 溶于热水 | 易溶于乙醇、乙醚 |
 注:刺形分馏柱的作用相当于二次蒸馏,用于沸点差别不太大的混合物的分离
注:刺形分馏柱的作用相当于二次蒸馏,用于沸点差别不太大的混合物的分离查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com