
 工业上合成合成氨的热化学方程式如下:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol
工业上合成合成氨的热化学方程式如下:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol分析 (1)根据平衡常数的概念写出该反应的化学平衡常数表达式;
(2)有化学平衡移动的可以用勒夏特列原理解释,
A.加入催化剂平衡不移动,不能用勒夏特列原理解释;
B.合成氨的反应正向为气体体积减小的反应,增大反应容器的压强(50MPa),平衡正向移动;
C.合成氨的反应为放热反应,升高反应的温度(5000C) 平衡逆向移动,反应物的转化率减小,不能用勒夏特列原理解释;
D.设法分离产生的氨气平衡正向移动,能用勒夏特列原理解释;
(3)①根据公式v=$\frac{△c}{△t}$计算;
②若容器为体积可变的恒压容器,在4min时往容器中再加入N2和H2各1mol,反应物的浓度增大,生成物的浓度减小,平衡向右移动,温度未发生变化,平衡常数不变;根据等效平衡知识,反应一段时间后,在t min时再次达到平衡时H2的物质的量为原平衡的2倍.
解答 解:(1)反应N2(g)+3H2(g)?2NH3(g)的平衡常数表达式为:K=$\frac{{c}^{2}(N{H}_{3})}{c({N}_{2})•{c}^{3}({H}_{2})}$,
故答案为:K=$\frac{{c}^{2}(N{H}_{3})}{c({N}_{2})•{c}^{3}({H}_{2})}$;
(2)A.加入催化剂平衡不移动,不能用勒夏特列原理解释,故A错误;
B.合成氨的反应正向为气体体积减小的反应,增大反应容器的压强(50MPa),平衡正向移动,能用勒夏特列原理解释,故B正确;
C.合成氨的反应为放热反应,升高反应的温度(5000C) 平衡逆向移动,反应物的转化率减小,不能用勒夏特列原理解释,故C错误;
D.设法分离产生的氨气,生成物浓度减小,平衡正向移动,能用勒夏特列原理解释,故D正确;
故答案为:BD;
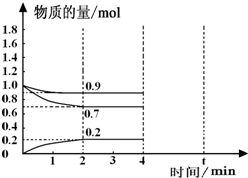
(3)①根据公式v=△n/V△t计算;根据图象可知,反应开始2分钟 NH3的物质的量变化为0.2mol,容器的体积为2L,则反应速率v=$\frac{\frac{0.2mol}{2L}}{2min}$=0.05mol/(L•min),
故答案为:0.05mol/(L•min);
②若容器为体积可变的恒压容器,在4min时往容器中再加入N2和H2各1mol,反应物的浓度增大,生成物的浓度减小,平衡向右移动,温度未发生变化,平衡常数不变,
故答案为:向右;不变;
(4)根据等效平衡知识,反应一段时间后,在t min时再次达到平衡时H2的物质的量为原平衡的2倍.H2在4min-t min时间内物质的量的变化曲线为: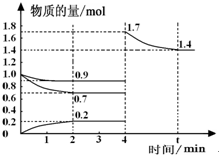 ,
,
故答案为: .
.
点评 本题考查化学平衡的计算,题目难度中等,涉及化学反应速率和化学平衡的计算及图象,旨在考查学生对基础知识的理解掌握,明确化学平衡及其影响为解答关键,试题培养了学生的分析能力及灵活应用能力.


 鹰派教辅衔接教材河北教育出版社系列答案
鹰派教辅衔接教材河北教育出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 在混合物中加入足量浓硫酸,加热、过滤 | |
| B. | 在混合物中加入足量NaOH溶液,过滤 | |
| C. | 用磁石将铁粉吸出 | |
| D. | 在混合物中加入足量浓硝酸,加热、过滤 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2KClO3$\frac{\underline{MnO_2}}{△}$2KCl+3O2↑ | B. | Fe+CuSO4═FeSO4+Cu | ||
| C. | 2H2O $\frac{\underline{\;通电\;}}{\;}$ 2H2↑+O2↑ | D. | Cl2+2NaOH═NaCl+NaClO+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某气体能使品红溶液褪色,则该气体是SO2 | |
| B. | 向某溶液中加入AgNO3溶液,产生白色沉淀,则原溶液中有Cl- | |
| C. | 某溶液中加入稀盐酸,不产生白色沉淀,再加入BaCl2溶液,产生白色沉淀,原溶液中有SO42- | |
| D. | 某溶液中加入盐酸产生无色气体,且该气体能使澄清石灰水变浑浊,则原溶液中一定含有CO32-或者HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
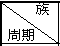 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅦA | ⅧA | O |
2 | N | O | F | |||||
3 | Na | Mg | Al | S | Cl | Ar | ||
4 | K |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 14 | B. | 28 | C. | 31 | D. | 35.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
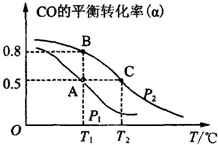 (1)已知:3H2(g)+3CO(g)═CH3OCH3(g)+CO2(g),△H=-247kJ/mol.一定条件下的密闭容器中,该总反应达到平衡,要提高CO的转化率,可以采取的措施是AE.
(1)已知:3H2(g)+3CO(g)═CH3OCH3(g)+CO2(g),△H=-247kJ/mol.一定条件下的密闭容器中,该总反应达到平衡,要提高CO的转化率,可以采取的措施是AE.| 物质 | CH3OH | CH3OCH3 | H2O |
| 浓度/(mol•L-1) | 0.01 | 0.2 | 0.2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com