
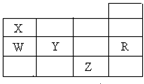
 表为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是( )
表为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是( )

科目:高中化学 来源: 题型:阅读理解
| 元素 | 相关信息 |
| X | X的基态原子核外3个能级上有电子,且每个能级上的电子数相等 |
| Y | 常温常压下,Y单质是淡黄色固体,常在火山口附近沉积 |
| Z | Z和Y同周期,Z的电负性大于Y |
| W | W的一种核素的质量数为63,中子数为34 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 元素 | 相关信息 |
| X | 组成蛋白质的基础元素,其最高正化合价与最低负化合价的代数和为2 |
| Y | 地壳中含量最高的元素 |
| Z | 存在质量数为23,中子数为11的核素 |
| W | 生活中大量使用其合金制品,工业上可用电解熔融氧化物的方法制备其单质 |
| R | 有多种化合价,其白色氢氧化物在空气中会迅速变成灰绿色,最后变成红褐色 |




查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素 | 相关信息 |
| X | X的氢化物分子中含10个电子,呈正四面体结构 |
| Y | Y与X同周期,其最高价氧化物对应的水化物是一种强氧化性酸 |
| Z | 第三周期元素中,Z电负性最小 |
| W | W的基态原子核外M能层上填满了电子,N能层只有1个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| 元素 | 相关信息 |
| X | X的基态原子核外3个能级上有电子,且每个能级上的电子数相等 |
| Y | M层上有2对成对电子 |
| Z | Z和Y同周期,Z的电负性大于Y |
| W | W的一种核素的质量数为63,中子数为34 |


查看答案和解析>>
科目:高中化学 来源: 题型:
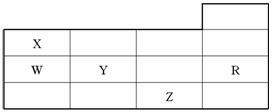
A.常压下五种元素的单质中Z单质的沸点最高
B.Y、Z的阴离子电子层结构都与R原子的相同
C.W的氢化物的沸点比X的氢化物的沸点高
D.Y元素的非金属性比W元素的非金属性强
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com