
| 时间(min) | 1 | 2 | 3 | 4 | 5 |
| 氢气体积(mL)(标准状况) | 100 | 240 | 464 | 576 | 620 |
分析 (1)①相同时间内收集的气体体积越多,该反应速率越快;温度越高化学反应速率越快;
②先计算生成氢气物质的量,再根据关系式计算消耗n(HCl),利用c=$\frac{\frac{△n}{V}}{△t}$计算盐酸反应速率;
(2)要降低反应速率,可以采用降低温度、降低氢离子浓度等方法实现;
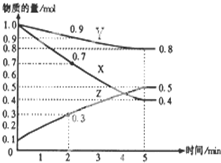
(3)①根据图知,随着反应进行,X、Y的物质的量减少而Z的物质的量增加,则X和Y是反应物而Z是生成物,反应达到平衡时,△n(X)=(1.0-0.4)mol=0.6mol、△n(Y)=(1.0-0.8)mol=0.2mol、△n(Z)=(0.5-0.1)mol=0.4mol,同一可逆反应中同一段时间内参加反应的各物质的物质的量变化量之比等于其计算之比,据此确定化学式;
②可逆反应达到平衡状态时,正逆反应速率相等,反应体系中各物质的物质的量、物质的量浓度、百分含量以及由此引起的一系列物理量不变;
③X的转化率=$\frac{反应的n(X)}{反应初始n(X)}$×100%;
④17g氨气的物质的量是1mol,1mol氨气分解吸收46kJ热量,则生成1mol氨气放出46kJ热量,生成2mol氨气放出92kJ热量.
解答 解:(1)①相同通条件下,反应速率越大,相同时间内收集的气体越多;由表中数据可知,反应速率最大的时间段是2~3 min,原因是:该反应是放热反应,温度越高,反应速率越大,
故答案为:2~3 min;该反应是放热反应,此时温度高,反应速率越大;
②3~4分钟时间段,收集的氢气体积=(576-464)mL=112mL,n(H2)=$\frac{0.112L}{22.4L/mol}$=0.005mol,根据氢气和HCl关系式得消耗的n(HCl)=2(H2)=2×0.005mol=0.01mol,则v(HCl)=$\frac{\frac{0.01mol}{0.4L}}{1min}$=0.025 mol/(L•min),
故答案为:0.025 mol/(L•min);
(2)A.加入蒸馏水,氢离子浓度减小,反应速率降低,故A不选;
B.加入KCl溶液,氢离子浓度降低,反应速率降低,故B不选;
C.加入KNO3溶液,相当于含有硝酸,硝酸和Zn反应生成NO而不是氢气,故C选;
D.加入CuSO4溶液,Zn和铜离子反应生成Cu,Zn、Cu和稀盐酸构成原电池而加快反应速率,故D选;
故选CD;
(3)①根据图知,随着反应进行,X、Y的物质的量减少而Z的物质的量增加,则X和Y是反应物而Z是生成物,反应达到平衡时,△n(X)=(1.0-0.4)mol=0.6mol、△n(Y)=(1.0-0.8)mol=0.2mol、△n(Z)=(0.5-0.1)mol=0.4mol,同一可逆反应中同一段时间内参加反应的各物质的物质的量变化量之比等于其计算之比,X、Y、Z的计量数之比=0.6mol:0.2mol:0.4mol=3:1:2,则该反应方程式为3X+Y?2Z,
故答案为:3X+Y?2Z;
②A.反应达到平衡状态时,各物质的反应速率之比等于其计量数之比,当X、Y、Z的反应速率相等时,该反应没有达到平衡状态,故A错误;
B.X、Y的反应速率比为3:1时,如果反应速率都是指同一方向的反应速率,则该反应不一定达到平衡状态,故B错误;
C.反应前后气体压强减小,当容器内气体压强保持不变时,各物质的物质的量不变,反应达到平衡状态,故C正确;
D.生成1mol Y的同时生成2mol Z,同时消耗2molZ,正逆反应速率相等,反应达到平衡状态,故D正确;
故选CD;
③X的转化率=$\frac{反应的n(X)}{反应初始n(X)}$×100%=$\frac{1.0mol-0.7mol}{1.0mol}$×100%=30%,
故答案为:30%;
④17g氨气的物质的量是1mol,1mol氨气分解吸收46kJ热量,则生成1mol氨气放出46kJ热量,生成2mol氨气放出92kJ热量,则该反应热化学方程式为N2(g)+3H2(g)?2NH3(g)△H=-92kJ/mol,
故答案为:N2(g)+3H2(g)?2NH3(g)△H=-92kJ/mol.
点评 本题考查化学平衡计算、化学平衡状态判断、化学反应速率影响因素等知识点,侧重考查学生分析判断及计算能力,明确化学反应原理、平衡状态判断方法等知识点是解本题关键,只有反应前后改变的物理量才能作为平衡状态判断依据,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 不能确定 | B. | 为40mL | C. | 为10mL | D. | 大于为40mL |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 150mL 2mol•L-1 KClO3溶液 | B. | 75mL 2mol•L-1CaCl2溶液 | ||
| C. | 150mL 2mol•L-1 KCl溶液 | D. | 75mL 1mol•L-1AlCl3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.20 | 0.10 | 0.09 | 0.08 | 0.08 | 0.08 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | MnS的Ksp比CuS的Ksp小 | |
| B. | 该反应达平衡时c(Mn2+)=c(Cu2+) | |
| C. | 设该反应的平衡常数为K,则该关系成立:K×Ksp(CuS)=Ksp(MnS) | |
| D. | 往平衡体系中加入少量CuSO4固体后,c(Cu2+)减小,c(Mn2+)变大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
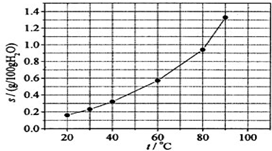
| A. | 温度升高时溴酸银溶解速度加快 | |
| B. | 若硝酸钾中含有少量溴酸银,可用重结晶方法提纯 | |
| C. | 60℃时溴酸银的Ksp约等于6×10-4 | |
| D. | 溴酸银的溶解是放热过程 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
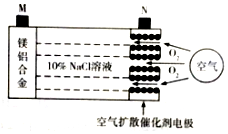 中科院宁波材料所研发金属空气电池获得重大突破.该电池的工作原理如图所示:下列有关说法正确的是( )
中科院宁波材料所研发金属空气电池获得重大突破.该电池的工作原理如图所示:下列有关说法正确的是( )| A. | 电池工作时,负极附近溶液的pH升高 | |
| B. | 电池工作时,电流由M极经外电路流向N极 | |
| C. | 电路中转移2mol电子,理论上约消耗标准状况下空气56L | |
| D. | 电池总反应为4Al+3O2=2Al2O3、2Mg+O2=2MgO |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com