
| 实验步骤 | 实验现象 | 用化学用语解释 |
| 将少量气体通入淀粉KI溶液 | 溶液最初变成 |
(用离子方程式表示) |
| 继续通入气体 | 溶液逐渐变成无色 | (用化学方程式表示) |
| ||
| ||
| 实验步骤 | 实验现象 | 用化学用语解释 |
| 蓝 | Cl2+2I-=I2+2Cl- | |
| 5Cl2+I2+6H2O=2HIO3+10HCl |


 课前课后同步练习系列答案
课前课后同步练习系列答案 课堂小作业系列答案
课堂小作业系列答案 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案 成功训练计划系列答案
成功训练计划系列答案 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案 一卷搞定系列答案
一卷搞定系列答案 名校作业本系列答案
名校作业本系列答案科目:高中化学 来源: 题型:
| 阳离子 | H+、NH4+、Mg2+、Ba2+、Al3+ |
| 阴离子 | OH-、Cl-、HCO3-、NO3-、SO42- |
| AgNO3溶液 |
| 稀HNO3 |
| 实验步骤 | 预期现象和结论 |
| 去C的溶液于试管中, |
预期现象和结论1: 预期现象和结论2: |
查看答案和解析>>
科目:高中化学 来源: 题型:
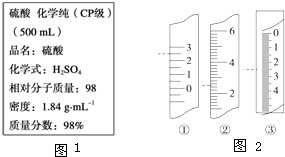 如图1是硫酸的试剂标签上的部分内容.某次学生实验需要0.5mol?L-1 H2SO4溶液480mL,若由你来配制所需溶液,请根据实验室已有的仪器和药品情况回答下列问题:
如图1是硫酸的试剂标签上的部分内容.某次学生实验需要0.5mol?L-1 H2SO4溶液480mL,若由你来配制所需溶液,请根据实验室已有的仪器和药品情况回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
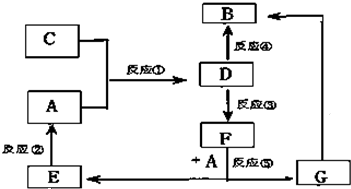
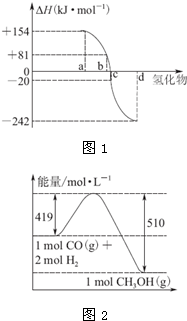 热力学标准态(298K、101kPa)下,由稳定单质发生反应生成1mol 化合物的反应热叫该化合物的生成热(△H).
热力学标准态(298K、101kPa)下,由稳定单质发生反应生成1mol 化合物的反应热叫该化合物的生成热(△H).| 800℃、Ar |
| Mg |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
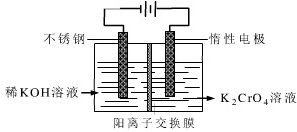
 电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在熔融电解质中,O2-移向负极 |
| B、电池的总反应是:2C4H10+13O2=8CO2+10H2O |
| C、通入空气的一极是正极,电极反应为:O2+4e-=2O2- |
| D、通入丁烷的一极是正极,电极反应为:C4H10+26e-+13O2-=4CO2↑+5H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、原溶液中的Br-不一定被氧化 |
| B、通入氯气之后原溶液中的Fe2+一定被氧化 |
| C、不能确定通入氯气之后的溶液中是否存在Fe2+ |
| D、若取少量所得溶液,再加入CCl4溶液,静置、分液,向上层溶液中加入足量的AgNO3溶液,能产生黄色沉淀 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com