
NA表示阿伏加德罗常数,下列说法正确的是( )
A. 1mol·L-l Na2CO3溶液中的Na+数目为2NA
B. 标准状况下,11.2 L CCl4所含分子数为0.5NA
C. 5.6 g铁分别与足量的盐酸、氯气反应,电子转移总数均为0.2NA
D. 1 mol Na与足量O2反应生成Na2O或Na2O2均失去NA电子
科目:高中化学 来源:2017届河北省高三上期末化学试卷(解析版) 题型:选择题
根据图中包含的信息分析,下列叙述正确的是(  )
)
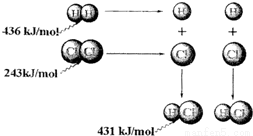
A.氢气与氯气反应生成1mol氯化氢气体,反应吸收248kJ的能量
B.436kJ/mol是指断开1molH 2 中的H-H键需要放出436kJ的能量
C.431kJ/mol是指生成2molHCl中的H-Cl键需要放出431kJ的能量
D.氢气与氯气反应生成2mol氯化氢气体,反应放出183kJ的能量
查看答案和解析>>
科目:高中化学 来源:2016-2017学年新疆兵团第二师华山中学高二上学期期末考试化学试卷(解析版) 题型:选择题
常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A. 使甲基橙呈红色的溶液中:K+、Ba2+、OH-、AlO2-
B. 由水电离出C(H+)=1×10-14溶液中:Ca2+、K+、Cl-、HCO3-
C. C(H+)/C(OH-)=1012的溶液中:NH4+、Al3+、NO3-、Cl-
D. C(Fe3+)=0.1mol/L的溶液中: K+、CO32-、SO42-、SCN-
查看答案和解析>>
科目:高中化学 来源:2016-2017学年安徽省淮北市高一下学期第一次月考化学试卷(解析版) 题型:选择题
已知氯气和NaOH在一定温度下能发生反应:Cl2+2NaOH=NaCl+NaClO+H2O;3Cl2+6NaOH=5NaCl+NaC1O3+3H2O。某温度下,将氯气通入NaOH溶液中,反应得到NaCl、NaClO、NaClO3的混合溶液。经测定ClO-与ClO3-的物质的量之比为4:1,则溶液中NaCl与NaClO的物质的量之比为( )
A. 9:4 B. 11:2 C. 5:1 D. l:l
查看答案和解析>>
科目:高中化学 来源:2016-2017学年安徽省淮北市高一下学期第一次月考化学试卷(解析版) 题型:选择题
常温下,四个容积为VL的容积中分别装有质量相同的下列气体,产生的压强最大的是( )
A. Cl2 B. HCl C. SO2 D. CO2
查看答案和解析>>
科目:高中化学 来源:江西省新余市、宜春中学2017届高三下学期开学联考理科综合-化学试卷 题型:简答题
软锰矿的主要成分为MnO2,含少量Al2O3和SiO2。闪锌矿主要成分为ZnS,含少量FeS、CuS、CdS杂质。现以软锰矿和闪锌矿为原料制备MnO2和Zn,其简化流程如下(中间产物的固体部分已经略去)。
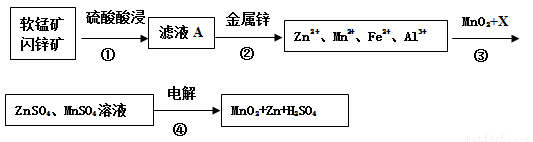
已知: Ⅰ.矿石中所有金属元素在滤液A中均以离子形式存在。
Ⅱ.各种金属离子完全沉淀的pH如下表:
Zn2+ | Mn2+ | Fe2+ | Fe3+ | Al3+ | |
pH | 8.0 | 10.1 | 9.0 | 3.2 | 4.7 |
回答下列问题:
(1)步骤①中为了加快硫酸的浸取速率,可采用的方法是_________________(任写一种)。①中发生多个反应,其中MnO2、FeS与硫酸共热时有淡黄色物质析出,溶液变为棕黄色,写出MnO2、FeS与硫酸共热发生反应的化学方程式______________________。
(2)步骤②加入金属锌是为了回收金属,回收金属的主要成分是_________。
(3)步骤③中MnO2的其作用是__________________,另外一种物质X可以是__________。
A.ZnO B.MgCO3 C.MnCO3 D.Cu(OH)2
(4)MnO2与Li构成LiMnO2,它可作为某锂离子电池的正极材料,电池反应方程式为: Li1-xMnO2+LixC6=LiMnO2+6C,写出该锂离子电池的正极电极反应式__________。
(5)已知:HCN的电离常数K=4.9×10-10,H2S的电离常数K1=1.3×10―7,K2=7.0×10―15,向NaCN溶液中通入少量的H2S气体,反应的离子方程式为__________________。在废水处理领域中常用H2S将Mn2+转化为MnS除去,向含有0.020 mol·L―1Mn2+废水中通入一定量的H2S气体,调节溶液的pH=a,当HS―浓度为1.0×10―4 mol·L―1时,Mn2+开始沉淀,则a=______。[已知:Ksp(MnS)=1.4×10―15]
查看答案和解析>>
科目:高中化学 来源:江西省新余市、宜春中学2017届高三下学期开学联考理科综合-化学试卷 题型:选择题
明朝《菽园杂记》有海水提取食盐的记载:“烧草为灰,布在滩场,然后以海水渍之,侯晒结浮白,扫而复淋”。该过程中“灰”的作用是( )
A. 萃取 B. 吸附 C. 结晶 D. 蒸发
查看答案和解析>>
科目:高中化学 来源:2017届吉林省高三第五次模拟化学卷(解析版) 题型:实验题
铁的化合物有广泛用途,如碳酸亚铁(FeCO3)可作为补血剂,铁红(Fe2O3)可作为颜料。利用某硫酸厂产生的烧渣(主要含Fe2O3、FeO,还有一定量的SiO2)制备碳酸亚铁的流程如下:
(1)“酸溶”时加快反应速率的方法有________________________________(写出一种)。
(2)①“还原”时,FeS2与H2SO4不反应,Fe3+通过两个反应被还原,其中一个反应如下:FeS2 +14Fe3+ +8H2O=15Fe2+ +2SO42-+16H+,则另一个反应的离子方程式为:___________________;②FeS2还原后,检验Fe3+是否反应完全的方法是_______________________。
(3)①“沉淀”时,需控制pH不宜过高,否则生成的FeCO3中可能混有____________杂质;
②写出加入NH4HCO3生成“沉淀”的化学方程式:___________________________;
③所得FeCO3需充分洗涤,检验沉淀已洗涤干净的方法是_______________________。
(4)FeCO3浊液长时间暴露在空气中,会有部 分固体表面变为红褐色,同时释放出CO2,则与FeCO3反应的物质为___________________(填化学式)。
分固体表面变为红褐色,同时释放出CO2,则与FeCO3反应的物质为___________________(填化学式)。
(5)FeCO3在空气中煅烧生成Fe2O3时,也会生成FeO.现煅烧23.2kg的FeCO3,得到Fe2O3和FeO的混合物15.84kg.则Fe2O3的质量为___________kg。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年甘肃省天水市高二下学期开学考试化学试卷(解析版) 题型:选择题
废电池造成污染的问题日益受到关注。下列有关电池的说法正确的是
A. 构成原电池的正极和负极必须是两种不同的金属
B. 弱电解质在水中的电离程度报小,不能用作电池的电解质溶液
C. 原电池是将化学能完全转变为电能的装置
D. 回收废旧电池,可防止汞、镉和铅等重金属对土壤和水源的污染
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com