
现有0.1mol/L的AlCl3溶液和0.1mol/L的氢氧化钠溶液,进行下面的实验。
(1)在试管中盛有上述AlCl3溶液10mL,向其中逐渐滴入上述的NaOH溶液。
①加入10mLNaOH溶液时的现象是_ ___,加入30mLNaOH溶液时的现象是_ ___,加入35mLNaOH溶液时的现象是_ ___。
②生成沉淀质量最多时,需NaOH溶液_ ___mL。
(2)向盛有10mLNaOH溶液的试管中滴入AlCl3溶液,同时不停摇动试管,出现的现象是_ ___,至加入多少毫升AlCl3溶液时开始出现沉淀?_ ___,至加入多少毫升AlCl3溶液时沉淀量最多?_ ___。写出上述过程的有关离子方程式_ ___。
(1)当NaOH溶液滴入10mL0.1mol/LAlCl3溶液中时,整个过程可用图象表示如下:
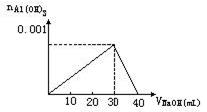
因为nAl3+=0.1×10×10-3=0.001(mol)
所以①当加入10mLNaOH溶液时现象是产生白色沉淀;加入30mL时,沉淀量最多;加入35mL时,沉淀部分溶解。
②生成沉淀最多时,需NaOH溶液30mL。
(2)当AlCl3溶液滴入NaOH溶液时,由于NaOH溶液是过量的,所以反应如下:
Al3++3OH-=Al(OH)3↓,
Al(OH)3+OH-=AlO2-+2H2O
上述两个方程式合并为:Al3++4OH-=AlO2-+2H2O,3AlO2-+Al3++6H2O=4Al(OH)3↓
可用图象表示如下:
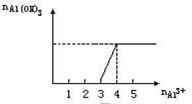 由于第一过程消耗的Al3+与第二过程消耗的Al3+之比为3:1,故开始产生沉淀与沉淀到最大所耗AlCl3溶液的体积比为3:1。
由于第一过程消耗的Al3+与第二过程消耗的Al3+之比为3:1,故开始产生沉淀与沉淀到最大所耗AlCl3溶液的体积比为3:1。
故开始时,现象为:有沉淀生成,但振荡后马上消失,开始沉淀时,需加入AlCl3的体积为xL
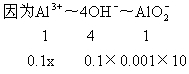
x=2.5(mL)
所以生成AlO2-为2.5×0.1×10-3mol=2.5×10-4mol
生成的AlO2-转化为Al(OH)3需Al3+为y
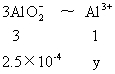
y=![]() (mol)
(mol)
沉淀最多时,需加入AlCl3的体积为![]()
![]() 0.1
0.1![]() 1000+2.5=
1000+2.5=![]() (mL)
(mL)


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
A.17.5% B.17.7% C.21.2% D.35%
查看答案和解析>>
科目:高中化学 来源: 题型:
(8分)现有①0.2mol/L NaOH溶液和②0.2mol/L HX溶液,两溶液等体积混合后,测得溶液中c(Na+)>c(X—)。则:
(1)①中由水电离出的c(OH-)__ ②中由水电离出的c(H+)。(填“>”、“=”或“<”)
(2)上述混合液中共存在 种粒子。其中:c(HX)+c(X—) 0.1mol/L(忽略混合前后溶液体积变化)(填“>”、“=”或“<”)。请根据电荷守恒写出一个用离子浓度表示的式子: 。
(3)上述混合液显 性(填“酸”、“碱”或“中”),其原因用离子方程式表示为 。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年山西省“晋商四校”高二下学期联考化学试卷(带解析) 题型:填空题
(8分)现有①0.2mol/L NaOH溶液和②0.2mol/L HX溶液,两溶液等体积混合后,测得溶液中c(Na+)>c(X—)。则:
(1)①中由水电离出的c(OH-)__ ②中由水电离出的c(H+)。(填“>”、“=”或“<”)
(2)上述混合液中共存在 种粒子。其中:c(HX)+c(X—) 0.1mol/L(忽略混合前后溶液体积变化)(填“>”、“=”或“<”)。请根据电荷守恒写出一个用离子浓度表示的式子: 。
(3)上述混合液显 性(填“酸”、“碱”或“中”),其原因用离子方程式表示为 。
查看答案和解析>>
科目:高中化学 来源:2013届山西省“晋商四校”高二下学期联考化学试卷(解析版) 题型:填空题
(8分)现有①0.2mol/L NaOH溶液和②0.2mol/L HX溶液,两溶液等体积混合后,测得溶液中c(Na+)>c(X—)。则:
(1)①中由水电离出的c(OH-)__ ②中由水电离出的c(H+)。(填“>”、“=”或“<”)
(2)上述混合液中共存在 种粒子。其中:c(HX)+c(X—) 0.1mol/L(忽略混合前后溶液体积变化)(填“>”、“=”或“<”)。请根据电荷守恒写出一个用离子浓度表示的式子: 。
(3)上述混合液显 性(填“酸”、“碱”或“中”),其原因用离子方程式表示为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com