
【题目】化学与社会、生活密切相关。对下列现象或事实的解释正确的是
现象或事实 | 解释 | |
A | 二氧化硅是生产光纤的原料 | 二氧化硅熔点高、硬度大、具有半导性 |
B | 氧化铝是一种较好的耐火材料 | 氧化铝是一种难熔物质 |
C | 食品的包装盒内常有小袋包装的硅胶或生石灰 | 其作用为防止富脂食品被氧化 |
D | 铜制器皿表面生成铜绿 | Cu与CO2、H2O反应生成碱式碳酸铜 |
A. A B. B C. C D. D
科目:高中化学 来源: 题型:
【题目】下列关于金属的叙述中正确的是( )
A.常温下金属单质都是固体
B.金属单质都能和稀硫酸反应产生氢气
C.金属单质在化学反应中只作还原剂
D.金属元素在自然界中都是以化合态存在的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ 当温度高于500 K时,科学家成功利用二氧化碳和氢气合成了乙醇,这在节能减排、降低碳排放方面具有重大意义。回答下列问题:
(1)该反应的化学方程式为________________________;
(2)在恒容密闭容器中,判断上述反应达到平衡状态的依据是________。
a.CO2与乙醇的浓度之比不再改变
b.单位时间内消耗H2和CO2的物质的量之比为3∶1
c.H2的体积分数保持不变
d.混合气体的平均相对分子质量不再改变
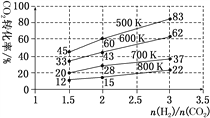
(3)在一定压强下,测得由CO2制取乙醇的实验数据中,起始投料比、温度与CO2的转化率的关系如图。根据图中数据分析:
①升高温度,平衡向________(正或逆)反应方向移动。
②在700 K、起始投料比![]() =1.5时,H2的体积分数为________(保留小数点后一位)。
=1.5时,H2的体积分数为________(保留小数点后一位)。
③在500 K、起始投料比![]() =2时,达到平衡后乙醇的浓度为a mol·L-1,则达到平衡时H2的浓度为________(保留小数点后两位)。
=2时,达到平衡后乙醇的浓度为a mol·L-1,则达到平衡时H2的浓度为________(保留小数点后两位)。
Ⅱ 汽车尾气中含有NO、CO和碳颗粒等有害物质,已成为某些大城市空气的主要污染源。
(1)汽车燃料中一般不含氮元素,汽缸中生成NO的原因为(可逆反应,用化学方程式表示)________________________________,且汽缸内温度越高,单位时间内NO排放量越大,试分析其原因____________________。

(2)治理汽车尾气中NO和CO污染的一种方法是将其转化为无害的CO2和N2,反应原理:2NO(g)+2CO(g) ![]() 2CO2(g)+N2(g) ΔH<0。某研究小组在三个容积均为5L的恒容密闭容器中,分别充入0.2molNO和0.2molCO,在三种不同实验条件下进行上述反应(体系各自保持温度不变),反应体系总压强随时间的变化如图所示。
2CO2(g)+N2(g) ΔH<0。某研究小组在三个容积均为5L的恒容密闭容器中,分别充入0.2molNO和0.2molCO,在三种不同实验条件下进行上述反应(体系各自保持温度不变),反应体系总压强随时间的变化如图所示。
①计算实验Ⅱ从开始至达到平衡时的反应速率v(NO)=________________。
②图中三组实验从开始至达到平衡时的反应速率v(NO)由小到大的顺序为________(填序号)。
③与实验Ⅱ相比,实验Ⅰ和实验Ⅲ分别仅改变一种反应条件,所改变的条件为:实验Ⅰ_______________________________;实验Ⅲ_______________________。
④三组实验中CO的平衡转化率αⅠ(CO)、αⅡ(CO)、αⅢ(CO)的大小关系为______________。判断依据为__________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SO2和NOx是大气污染物的主要成分。防止空气污染,保卫“深圳蓝”是深圳市一项重要民生工程。利用下图所示装置(电极均为惰性电极)可以吸收SO2还可以用阴极排出的溶液吸收NO2。下列说法不正确的是
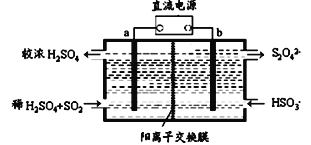
A. 电极a应连接电源的正极
B. 电极b上的电极反应式为2HSO3-+2e-+2H+=S2O42-+2H2O
C. 反应过程中,H+从b极室流向a极室
D. 每吸收标况下22.4L SO2,在b极室生成NA个S2O42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】联合国将2019年定为“国际化学元素周期表年”,2018年中国化学会制作了新版周期表,包含118种元素。回答下列问题:
(1)碳元素在周期表中的位置是______________。
(2)将硅的元素符号填写在上述周期表相应的空格中。________
(3)在上述周期表中,用实线画出周期表的上方边界。_______
(4)第118号元素为Og(中文名“![]() ”,ào),下列说法不正确的是____。
”,ào),下列说法不正确的是____。
a.Og是第七周期0族元素
b.Og原子的核外有118个电子
c.Og在同周期元素中非金属性最强
d.中子数为179的Og核素符号是![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化铈(CeO2)是一种主要的稀土氧化物。平板电视显示屏生产过程中产生大量的废玻璃粉末(含SiO2、Fe2O3、CeO2以及其他少量可溶于稀酸的物质)。某课题组就此粉末为原料回收铈,设计实验流程如下:
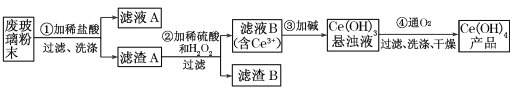
(1)洗涤滤渣A的目的是为了除去_____________(填离子符号),检验该离子是否洗净的方法是________________。
(2)第②步反应的离子方程式是___________________,滤渣B的主要成分是___________。
(3)萃取是分离稀士元素的常用方法,已知化合物TBP作为萃取剂能将铈离子从水溶液中萃取出来,TBP_______(填“能”或“不能”)与水互溶。实验室进行萃取操作时用到的主要玻璃仪器有___________、烧杯、玻璃棒、量筒等。
(4)取上述流程中得到的Ce(OH)4产品0.536 g,加硫酸溶解后,用0.1000 mol·L-1FeSO4标准溶液滴定至终点时(铈被还原为Ce3+),消耗25.00 mL标准维液,该产品中Ce(OH)4的质量分数为_______________(保留3位有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数值。下列有关叙述正确的是( )
A. 14 g乙烯和丙烯混合气体中的氢原子数为2NA
B. 1 mol N2与4 mol H2反应生成的NH3分子数为2NA
C. 1 mol Fe溶于过量硝酸,电子转移数为2NA
D. 标准状况下,2.24 L CCl4含有的共价键数为0.4NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com