
【题目】三氟化氮(NF3)是一种无色、无味的气体,它是微电子工业技术的关键原料之一,可由氨气和氟气反应得到:4NH3+3F2═NF3+3NH4F.在潮湿的空气中,NF3能与水蒸气发生氧化还原反应,其反应的产物有HF、NO和HNO3 . 下列说法正确的是( )
A.制取NF3的反应中,氧化剂与还原剂的物质的量之比为3:1
B.在NF3与H2O的反应中,H2O作还原剂
C.若在制取NF3的反应中有0.5 mol NH3参加反应,转移电子的物质的量为3 mol
D.NF3在空气中一旦泄漏,不易于发现
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】亚硫酸盐是一种常见的食品添加剂,用如图实验可检验某食品中亚硫酸盐含量(所 加试剂均足量). ![]()
下列说法不正确的是( )
A.亚硫酸盐作为食品添加剂,作用是防腐保鲜
B.反应①过程中通入N2的作用是将装置中空气和生成的气体全部赶出
C.测定样品质量及③中耗碱量,可测定样品中亚硫酸盐含量
D.若仅将②中的氧化剂“H2O2溶液”替换为碘水,对测定结果无影响
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】资料一:考古工作者从安阳的商代铸铜遗址中,发现当时冶炼铜的主要矿物原料是孔雀石(Cu2(OH)2CO3),主要燃料是木炭,冶炼温度估计在1000℃左右.
资料二:西汉刘安著《淮南万毕术》中记载“曾青得铁则化为铜”.“曾青”可能是硫酸铜一类的物质,将孔雀石溶于硫酸中得此溶液,当把铁粉投入此溶液中即可得铜.
(1)关于“曾青”和孔雀石的水溶性分析中,判断正确的是__________
A.前者可溶,后者难溶 B.前者难溶,后者可溶
C.两者均可溶 D.两者均难溶
(2)以孔雀石为原料的冶炼过程中,用现代化学的观念审视,可能涉及的化学反应有__________
①Cu2(OH)2CO3![]() 2CuO+CO2↑+H2O
2CuO+CO2↑+H2O
②2CuO+C ![]() 2Cu+CO2↑
2Cu+CO2↑
③CuO+CO ![]() Cu+CO2
Cu+CO2
④CO2+C ![]() 2CO
2CO
A.①② B.①③ C.①②③ D.①②③
(3)在(2)的四个反应中,不属于四种基本反应类型的有(填序号,下同)__________,不属于氧化还原反应的有__________.
(4)资料二中,假设溶解孔雀石的酸是稀硫酸,写出用此方法冶炼铜的化学方程式 ______________________________________________,
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某可逆反应mA(g)+nB(g)pC(g),在密闭容器中进行,如图表示在不同反应时间t、温度T和压强P与反应物B在混合气体中的百分含量B%的关系曲线,由曲线分析,下列判断正确的是( ) 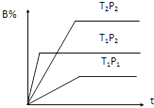
A.T1<T2、P1>P2、m+n>p,△H<0
B.T1>T2、P1<P2、m+n>p,△H>0
C.T1>T2、P1<P2、m+n<p,△H>0
D.T1<T2、P1>P2、m+n<p,△H<0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三室式电渗析法处理含Na2SO4废水的原理如图所示,采用惰性电极,ab、cd均为离子交换膜,在直流电场的作用下,两膜中间的Na+和SO42﹣可通过离子交换膜,而两端隔室中离子被阻挡不能进入中间隔室.下列叙述正确的是( ) 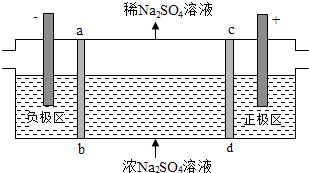
A.通电后中间隔室的SO42﹣离子向正极迁移,正极区溶液pH增大
B.该法在处理含Na2SO4废水时可以得到NaOH和H2SO4产品
C.负极反应为2H2O﹣4e﹣=O2+4H+ , 负极区溶液pH降低
D.当电路中通过1mol电子的电量时,会有0.5mol的O2生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国知名企业比亚迪公司开发了具有多项专利的锂钒氧化物二次电池,其成本较低,对环境无污染,能量密度远远高于其他材料电池,电池总反应为V2O5+xLi ![]() LixV2O5 . 下列说法中正确的是( )
LixV2O5 . 下列说法中正确的是( )
A.电池在放电时,Li+向负极移动
B.锂在放电时做正极,充电时为阳极
C.该电池充电时阳极的反应为LixV2O5﹣xe﹣═V2O5+xLi+
D.V2O5只是锂发生反应的载体,不参与电池反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】T℃时,在2L恒容密闭容器中气态物质X、Y、Z的物质的量随时间变化的部分数据如表所示:
T/min | n(X)/mol | n(Y)/mol | n(Z)/mol |
0 | 0.80 | 1.00 | 0 |
1 | 0.70 | 0.80 | |
5 | 0.70 | ||
9 | 0.40 | ||
10 | 0.40 | 0.80 |
(1)写出该反应的化学方程式
(2)反应进行到10min,X的转化率为 , 0~5min内Y的平均反应速率为
(3)计算T℃时该反应的平衡常数K=
(4)T℃下向该密闭容器中通入一定量的X、Y、Z,反应到某时刻测得X、Y、Z的物质的量分别为1.00mol、0.50mol、1.60mol,则此时正逆反应速率大小:v正v逆(填“大于”、“等于”、“小于”)
(5)若在10min和t3、t5时刻分别改变该反应的某一反应条件,得到X、Z的物质的量及反应速率与时间的关系如图A、B所示: 
①10min时改变的反应条件是
②t3时刻改变的反应条件是t5时刻改变的反应条件是 , 理由是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,液氨的离子积常数K=c(NH4+)c(NH2﹣)=1.6×10﹣29 , 若用定义pH一样来规定pN=﹣lg c(NH4+),则在该温度下,下列叙述正确的是( )
A.纯净的液氨中,pN=7
B.纯净的液氨中,c(NH4+)c(NH2﹣)>1.0×10﹣14
C.1 L溶解有0.001 mol NH4C1的液氨溶液,其pN=3
D.1 L溶解有0.001 mol NaNH2的液氨溶液,其pN=11
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某强酸性溶液中还可能存在Al3+、Fe2+、NH4+、Ba2+、Cl-、CO32-、SO42-、NO3-中的若干种,现取适量溶液进行如下一系列实验(已知硝酸根离子在酸性环境中具有强氧化性,还原产物一般为气体)

下列有关判断正确的是
A. 试液中一定有Fe2+、SO42-、H+、NH4+、Al3+
B. 试液中一定没有Ba2+、CO32-、NO3-
C. 步骤③中发生反应的离子方程式为:2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-
D. 沉淀B在空气中会迅速变为灰绿色,最后变为红褐色
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com