
| A. | 将四份溶液稀释相同倍数后,溶液的pH:③>④>①>② | |
| B. | 将①、④等体积混合,则混合液的PH为7 | |
| C. | 四份溶液中水的电离程度由大到小的顺序为:③>①=②=④ | |
| D. | 将②加入③至恰好完全反应,则消耗体积为③>② |
分析 四份溶液中溶质都是抑制水的电离的,①中CH3COOH电离出的H+浓度最小,②③④中电离出的H+、OH-浓度都为0.01 mol•L-1,其中醋酸和一水合氨为弱电解质,加水促进电离,结合浓度对弱电解质的电离的影响解答该题.
解答 解:A.将四份溶液稀释相同倍数后溶液的pH:氨水存在电离平衡,溶液中氢氧根离子浓度大于氢氧化钠溶液中氢氧根离子,③>④,同浓度醋酸和盐酸稀释相同倍数,醋酸存在电离平衡,不能完全电离,醋酸溶液中氢离子浓度小于盐酸溶液中的氢离子浓度,所以溶液pH①>②,故A正确;
B.若将①、④等体积混合,醋酸和氢氧化钠恰好反应生成醋酸钠,溶液呈碱性,故B错误;
C.四份溶液中溶质都是抑制水的电离的,其中②③④中H+、OH-浓度相等,对水的电离的抑制也相等,且大,①中CH3COOH电离出的H+浓度最小,因此其中水的电离程度最小,水的电离程度:①>②,故C错误;
D.一水合氨为弱电解质,②③若等体积混合后溶液呈碱性,0.01mol/L HCl和pH=12的氨水比较,前者的浓度小,所以恰好完全反应,则消耗体积为③<②,故D错误;
故选A.
点评 本题考查较为综合,涉及弱电解质的电离平衡应用,为高考常见题型,侧重于水的电离影响,溶液酸碱性的判断,溶液稀释的PH变化,关键是酸碱反应后溶液酸碱性的判断,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:多选题
| A. | HI、H2、I2的浓度相等 | B. | HI、H2、I2的浓度不再发生变化 | ||
| C. | HI、H2、I2在密闭容器中共存 | D. | 容器内气体的颜色不再发生变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 根据是否具有丁达尔效应,可将分散系分为溶液、浊液和胶体 | |
| B. | SiO2既能与NaOH溶液反应,又能与氢氟酸反应,但SiO2不属于两性氧化物 | |
| C. | AgCl的水溶液不易导电,故AgCl是弱电解质 | |
| D. | 烧碱、纯碱、熟石灰均属于碱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③⑧ | B. | ②③⑥⑦ | C. | ①③⑥⑦ | D. | ①④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ,
,查看答案和解析>>
科目:高中化学 来源: 题型:解答题
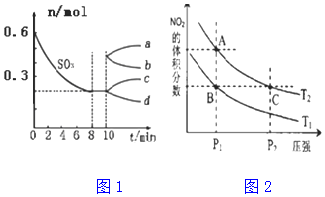
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
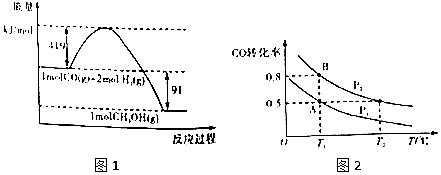
| 化学键 | H-H | H-O | O=O |
| 键能kj/mol | 436 | x | 496 |
| 容器 | 甲 | 乙 | 丙 |
| 相关条件 | 恒温恒容 | 绝热恒容 | 恒温恒压 |
| 反应物投料 | 1molCO、2molH2 | 1molCH3OH | 1molCH3OH |
| 平衡时容器体积 | V(甲) | V(乙) | V(丙) |
| 反应的平衡常数K | K(甲) | K(乙) | K(丙) |
| 平衡时CH3OH的浓度/mol•L-1 | C(甲) | C(乙) | C(丙) |
| 平衡时CH3OH的反应速率/mol•L-1•min-1 | v(甲) | v(乙) | v(丙) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用托盘天平称取35.20g NaOH | |
| B. | 用10mL量筒量取8.50mL浓盐酸配一定物质的量浓度溶液 | |
| C. | 用25ml滴定管量取15.80ml浓溶液配一定物质的量浓度溶液 | |
| D. | 用pH试纸测得溶液pH为4.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
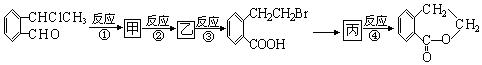
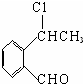 +O2$\stackrel{催化剂}{→}$2
+O2$\stackrel{催化剂}{→}$2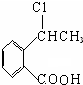 ,氧化反应.
,氧化反应. +NaOH$→_{△}^{CH_{3}CH_{2}OH}$
+NaOH$→_{△}^{CH_{3}CH_{2}OH}$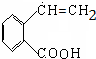 +NaCl+H2O,消去反应.
+NaCl+H2O,消去反应. →丙实际需要两步才能完成,写出第一步反应的化学方程式
→丙实际需要两步才能完成,写出第一步反应的化学方程式 +2NaOH$→_{△}^{H_{2}O}$
+2NaOH$→_{△}^{H_{2}O}$ +NaBr+H2O,第二步所用试剂及目的是试剂是盐酸,目的是将钠盐酸化生成对应的酸.
+NaBr+H2O,第二步所用试剂及目的是试剂是盐酸,目的是将钠盐酸化生成对应的酸.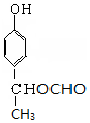 和
和 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com