
 ?C(g)达到平衡时,C的物质的量分数为40%,
?C(g)达到平衡时,C的物质的量分数为40%, ?C(g)
?C(g)| a |
| 3-a |
| 6 |
| 7 |
| 6 |
| 7 |
| 15 |
| 7 |
 ?C(g)
?C(g)| x |
| 1-x+1-x+x |
| 4 |
| 7 |
 ?C(g)达到平衡时,C的物质的量分数为40%,
?C(g)达到平衡时,C的物质的量分数为40%, ?C(g)
?C(g)| a |
| 3-a |
| 6 |
| 7 |
| 6 |
| 7 |
| 15 |
| 7 |
| 30 |
| 7 |
| 30 |
| 7 |
| 1 |
| 3 |
| 10 |
| 7 |
| 10 |
| 7 |
 ?C(g)
?C(g)| x |
| 1-x+1-x+x |
| 4 |
| 7 |
2mol-
| ||
| 2mol |
| 5 |
| 7 |
| 5 |
| 7 |


 轻巧夺冠周测月考直通中考系列答案
轻巧夺冠周测月考直通中考系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
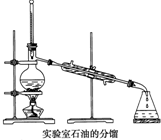 实验室中常采用如图所示装置进行石油分馏,请回答下列问题:
实验室中常采用如图所示装置进行石油分馏,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
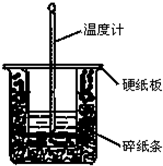 50mL 0.50mol?L-1盐酸与50mL 0.55mol?L-1NaOH溶液在图示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
50mL 0.50mol?L-1盐酸与50mL 0.55mol?L-1NaOH溶液在图示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、容器Ⅰ、Ⅱ中正反应速率相同 |
| B、容器Ⅰ、Ⅲ中反应的平衡常数相同 |
| C、容器Ⅰ中A的物质的量比容器Ⅱ中的多 |
| D、容器Ⅰ中A的转化率与容器Ⅱ中C的转化率之和小于1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、原子晶体中只存在非极性共价键 |
| B、稀有气体形成的晶体属于分子晶体 |
| C、干冰升华时,分子内共价键会发生断裂 |
| D、金属元素和非金属元素形成的化合物一定是离子化合物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com