
分析 (1)根据盖斯定律可知:若是一个反应可以分步进行,则各步反应的吸收或放出的热量总和与这个反应一次发生时吸收或放出的热量相同来判断;
(2)根据由盖斯定律可知:①C(s)+O2(g) $\frac{\underline{\;点燃\;}}{\;}$CO2(g) (1mol碳单质反应放热Q1 kJ)
②C(s)+H2O(g) $\frac{\underline{\;点燃\;}}{\;}$CO(g)+H2(g) (1mol碳单质反应吸热Q2 kJ)
③2CO(g)+O2(g)$\frac{\underline{\;点燃\;}}{\;}$2CO2(g)
2H2(g)+O2(g) $\frac{\underline{\;点燃\;}}{\;}$2H2O(g)(1molCO和1molH2反应共放热Q3 kJ)
根据盖斯定律①=$\frac{③}{2}$-②计算;
(3)根据吸热反应中,反应物所具有的总能量小于生成物所具有的总能量以及能量守恒;
(4)根据煤通过途径Ⅱ作为燃料燃烧后产物无污染、燃烧效率高等.
解答 解:(1)由盖斯定律可知:若是一个反应可以分步进行,则各步反应的吸收或放出的热量总和与这个反应一次发生时吸收或放出的热量相同,故答案为:等于;
(2)由盖斯定律可知:①C(s)+O2(g) $\frac{\underline{\;点燃\;}}{\;}$CO2(g) (1mol碳单质反应放热Q1 kJ)
②C(s)+H2O(g) $\frac{\underline{\;点燃\;}}{\;}$CO(g)+H2(g) (1mol碳单质反应吸热Q2 kJ)
③2CO(g)+O2(g)$\frac{\underline{\;点燃\;}}{\;}$2CO2(g)
2H2(g)+O2(g) $\frac{\underline{\;点燃\;}}{\;}$2H2O(g)(1molCO和1molH2反应共放热Q3 kJ)
根据盖斯定律①=$\frac{③}{2}$-②,所以Q1=$\frac{Q{\;}_{3}}{2}$-Q2;故答案为:Q1=$\frac{Q{\;}_{3}}{2}$-Q2;
(3)因吸热反应中,反应物所具有的总能量小于生成物所具有的总能量,以及在化学反应中能量守恒,所以反应物就需要吸收能量才能转化为生成物,故答案为:低于;吸收;高温;
(4)因煤通过途径Ⅱ作为燃料燃烧后产物无污染、燃烧效率高等,
故答案为:固体煤经处理变为气体燃料后,不仅在燃烧时可以大大减少SO2和烟尘对大气造成的污染,而且燃烧效率高,也便于输送.
点评 本题主要考查了盖斯定律的应用,同时还考查了煤的气化,难度不大.


 一本好题口算题卡系列答案
一本好题口算题卡系列答案科目:高中化学 来源: 题型:选择题
| A. | 电解稀硫酸溶液实质上是电解水,故溶液pH不变 | |
| B. | 电解稀氢氧化钠溶液要消耗OH-,故溶液pH减小 | |
| C. | 电解硫酸钠溶液,在阴极上发生反应:4OH-4e-═2H2O+O2↑ | |
| D. | 电解氯化铜溶液,在阴极上和阳极上析出产物的物质的量之比为1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应的平衡常数表达式为k=$\frac{{c}^{3}(C)•c(D)}{{c}^{2}(A)•{c}^{3}(B)}$ | |
| B. | 升高温度,该反应的平衡常数增大 | |
| C. | 从反应开始10min,该反应的平均反应速率v(C)为0.12mol/(L•min) | |
| D. | B的平衡转化率为60% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,分子中氮原子轨道的杂化类型是sp3.
,分子中氮原子轨道的杂化类型是sp3.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 :2-甲基戊烷;
:2-甲基戊烷; 乙苯
乙苯  4-甲基-2-戊炔.
4-甲基-2-戊炔.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②⑤⑥ | B. | ④⑥⑦ | C. | ③④⑦ | D. | 以上都不正确 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 在一个体积为2L的真空密闭容器中加入0.5molCaCO3,发生反应CaCO3(s)=CaO (s)+CO2(g),测得二氧化碳的物质的量浓度随温度的变化关系如图表示,图中A表示CO2的平衡浓度与温度的关系曲线,B表示不同温度下反应经过相同时间时CO2的物质的量浓度的变化曲线.请按要求回答下列问题:
在一个体积为2L的真空密闭容器中加入0.5molCaCO3,发生反应CaCO3(s)=CaO (s)+CO2(g),测得二氧化碳的物质的量浓度随温度的变化关系如图表示,图中A表示CO2的平衡浓度与温度的关系曲线,B表示不同温度下反应经过相同时间时CO2的物质的量浓度的变化曲线.请按要求回答下列问题:| 物质 | 电离平衡常数(25℃) |
| C6H5OH | Ki=1.28×10-10 |
| H2CO3 | Ki1=4.3×10-7 |
| Ki2=5.6×10-11 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
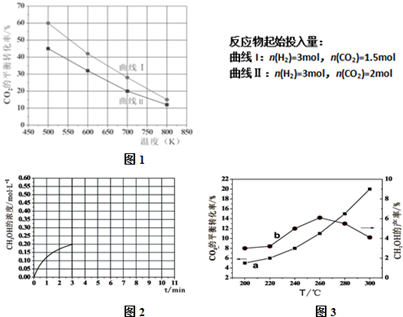
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 | B. | 2 | C. | 3 | D. | 4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com