
����Ŀ���о�CO2�����öԴٽ���̼���Ĺ���������Ҫ���塣
(1)һ�������£���CO2������̼��Ӧ����ƽ����ϵ�м���H2���ʵ������������з�Ӧ������
CO(g)��3H2(g)![]() CH4(g)��H2O(g) H1��-206.2 kJ/mol
CH4(g)��H2O(g) H1��-206.2 kJ/mol
CO(g)��H2O(g)![]() CO2(g)��H2(g) H2
CO2(g)��H2(g) H2
��CO2��ԭH2����0.1molCH4(g)��һ������H2O(g)�����������зų�������Ϊ16.5kJ�����H2=____________��
(2)Ϊ�о�CO2��CO֮���ת������һ������CO2������̼������ɱ���ܱ������з�Ӧ��C(s)��CO2(g)![]() 2CO(g) H�����ѹǿ���¶ȶ�CO���������(��(CO)��)��Ӱ����ͼ��ʾ��
2CO(g) H�����ѹǿ���¶ȶ�CO���������(��(CO)��)��Ӱ����ͼ��ʾ��

�ش��������⣺
��p1��p2��p3�Ĵ�С��ϵ��______________��ͼ��a��b��c�����Ӧ��ƽ�ⳣ����С��ϵ��____________��
��900�桢1.013MPaʱ��1molCO2������̼��Ӧ��ƽ������������ΪVL��CO2��ת����Ϊ_____________��(����һλС��)�÷�Ӧ��ƽ�ⳣ��K��_________��
�۽�����ƽ����ϵ�¶Ƚ���640�棬ѹǿ����0.1013MPa�����´ﵽƽ���CO2���������Ϊ50%�������ı�ʱ������Ӧ���淴Ӧ������α仯��_______________________________������֮���кι�ϵ��________________________��

(3)CO2�����ڹ�ҵ�Ʊ�����п����ԭ����ͼ��ʾ(���Һ���μӷ�Ӧ)��Zn�缫��_____������֪��Pb�缫���õ�ZnC2O4����Pb�缫�ϵĵ缫��ӦʽΪ______________��
���𰸡�-41.2 kJ/mol p1��p2��p3 Ka��Kb��Kc 66.7% 16/3Vmol/L ����Ӧ���淴Ӧ���ʾ���С v(��)��v(��) �� 2CO2+2e-=C2O42-
��������
(1) ��CO2��ԭH2����0.1mol CH4(g)��һ������H2O(g)�����������зų�������Ϊ16.5kJ���ɵ÷�Ӧ��CO2(g)��4H2(g)![]() CH4(g)��2H2O(g) H3��-165.0 kJ/mol��
CH4(g)��2H2O(g) H3��-165.0 kJ/mol��
��CO(g)��3H2(g)![]() CH4(g)��H2O(g) H1��-206.2 kJ/mol
CH4(g)��H2O(g) H1��-206.2 kJ/mol
���ݸ�˹���ɣ��ɢ�-�۵÷�ӦCO(g)��H2O(g)![]() CO2(g)��H2(g) ����H2=H1-H3��-206.2 kJ/mol+165.0 kJ/mol=-41.2 kJ/mol��
CO2(g)��H2(g) ����H2=H1-H3��-206.2 kJ/mol+165.0 kJ/mol=-41.2 kJ/mol��
��2��������Ӧ���������Ŀ��淴Ӧ������ѹǿCO�ĺ������͡�����ͼ���֪���¶����ʱp1��Ӧ��CO������ߣ���p1��p2��p3�Ĵ�С��ϵ��p1��p2��p3�������¶�CO�������ߣ�˵������Ӧ�����ȷ�Ӧ��ƽ�ⳣ��ֻ���¶��й�ϵ�������¶�ƽ�����ƣ�ƽ�ⳣ��������ͼ��a��b��c�����Ӧ��ƽ�ⳣ����С��ϵ��Ka��Kb��Kc��
��900 �桢1.013 MPaʱCO�ĺ�����80%����
C(s)��CO2(g) ![]() 2CO(g)
2CO(g)
��ʼ����mol�� 1 0
ת������mol�� x 2x
ƽ������mol�� 1��x 2x
���![]() �����x��
�����x��![]() ����CO2��ת����Ϊ66.7%��
����CO2��ת����Ϊ66.7%��
��Ӧ��ƽ�ⳣ��K=![]() =
=![]() ��
��
��ƽ����ϵ�¶Ƚ���640 ����ѹǿ����0.1013 MPa�����´ﵽƽ���CO2���������Ϊ50%��˵��ƽ�����淴Ӧ������У���v(��)��v(��)��
��3����װ���ǵ��أ��缫������Ϊ����������������Ϣ��Znʧ���ӣ����п����������Pb������ZnC2O4����������缫��ӦʽΪ2CO2+2e-=C2O42-��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����2A��B![]() 3C��4D��Ӧ�У���ʾ�÷�Ӧ���������ǣ� ��
3C��4D��Ӧ�У���ʾ�÷�Ӧ���������ǣ� ��
A. �ԣ�A���� 0.5 mol/��L���� B. �ԣ�B���� 18 mol/��L��min��
C. �ԣ�C���� 0.8 mol/��L���� D. �ԣ�D���� 1 mol/�� L����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ŀǰ��ҵ�ϳɰ���ԭ������N2(g)+3H2(g)![]() 2NH3(g) ��H=-93.0kJ/mol
2NH3(g) ��H=-93.0kJ/mol
(1)��֪һ����������2N2(g)+6H2O(l)![]() 4NH3(g)+3O2(g) ��H=+1530.0kJ/mol�����ʾ����ȼ���ȵ��Ȼ�ѧ����ʽΪ____________________��
4NH3(g)+3O2(g) ��H=+1530.0kJ/mol�����ʾ����ȼ���ȵ��Ȼ�ѧ����ʽΪ____________________��
(2)�ں��º���װ���н��кϳɰ���Ӧ�������Ũ��-ʱ��ͼ�����¡�

�� ��ʾN2Ũ�ȱ仯�������� (�����)��
�� ǰ25min �ڣ���H2Ũ�ȱ仯��ʾ�Ļ�ѧ��Ӧ������ ��
�� ��25minʱ����ȡ���д�ʩ����ʹN2��ת������ߵ���__________(�����)��
a. ͨ��1molN2
b. ͨ��1molH2
c. ͨ��1molHe��
d. ͨ��1molHCl
e. ͨ��1molN2��3molH2
(3)�ں��º�ѹװ���н��й�ҵ�ϳɰ���Ӧ������˵���������__________(�����)��
a������������ٱ仯������ƽ��
b�������ܶȲ��ٱ仯������ƽ��
c��ƽ���ѹ�������������ɸ���NH3
d��ƽ�����װ����ͨ��һ����Ar��ƽ�ⲻ�ƶ�
(4)�糧�����ѵ�������ӦΪ����4NH3(g)+6NO(g)![]() 5N2(g)+6H2O(g) ��H<0
5N2(g)+6H2O(g) ��H<0
����ӦΪ����2NH3(g)+8NO(g)![]() 5N2O(g)+3H2O(g) ��H>0
5N2O(g)+3H2O(g) ��H>0
ƽ��������N2��N2O�������¶ȵĹ�ϵ��ͼ��ʾ��

��ش���400��600Kʱ�����¶ȵ����ߣ�ƽ��������N2����_____________(������������������������������)���������ֹ��ɵ�ԭ����_______________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾ����100mL0.100molL��1Na2CO3��Һ�ļ����ؼ�ʵ�鲽��Ͳ�������ͼ�ش��������⣺
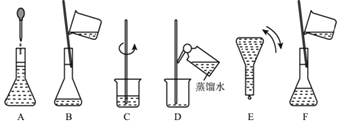
��1��������ƿ����һ�����ʵ���Ũ�ȵ���Һ��������ƿ������_____��
������� ��ƿ����©ˮ�� ���������Ƶ���Һ��ϴ���� �������������Ҫ���
��2������Na2CO310H2O��������Һ����Ҫ��������_____�ˡ�������ȡ�ľ����Ѿ���һ����ʧȥ�˽ᾧˮ���������Ƶ���ҺŨ��ƫ_____�������/С����
��3��д��������Һ������Ҫ�õ��IJ������������ƣ��ձ���_____��
��4������Bͨ����Ϊת�ƣ�����Aͨ����Ϊ_____������D��Ϊ_____����û�в���D�������Ƶ�Ũ��ƫ_____�������/С������
��5��������ʵ�鲽��A��F��ʵ������Ⱥ��������_____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijѧ��̽������ʵ��(A)��
ʵ��A | ���� | ���� |
| ���� | i�����Ⱥ���ɫ��ȥ ii����ȴ�����У���Һ�ָ���ɫ ��.һ��ʱ�����ɫ������ȥ |
��1��ʹ���۱�����������____��
��2����������i��ii��Ϊ�������������£����ȴٽ�����ˮ�⣬��ȴ��ƽ�������ƶ���
���ʵ�����£�������a��֤ʵ�÷�����������

������a����____��
��3���ٴη��������Ⱥ��ʵⷢ���˱仯��ʵ�����£�
I��ȡ������ˮ����������ɫ���õ�����Һ����ӷ��������ʣ�������
������ɫ�����Һ�еμӵ�����Һ����ȴ������һֱδ����������ϡH2SO4��˲�������
�Բ������ϡH2SO4�����ã�������ӷ���ʽ�����һ�ֺ����Ľ��ͣ�______________��
��4��̽����ˮ��ɫ����Һ�ijɷ֣�
ʵ��1�������Һ��pH��5
ʵ��2��ȡ��ɫ�����Һ���������ʵ�飺

�ٲ�����ɫ���������ӷ���ʽ��____��
��Ag2O��������____________��
����������ʵ�飬�Ʋ���Һ�к��е����ʣ������ӣ�������_________��
��5����ϻ�ѧ��Ӧ���ʽ���ʵ��A������i������iii��ɫ��ȥ��ԭ��_______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���״������ǿ��������õ�һ������Դ����֪��
��2H2(g)��O2(g)===2H2O(l) ��H1����571.8 kJ��mol��1��
��CH3OH(g)��1/2O2(g)===CO2(g)��2H2(g) ��H2����192.9 kJ��mol��1
��1���״�������ȫȼ�յ��Ȼ�ѧ����ʽΪ_____________________________________
��2����Ӧ���е������仯��ͼ��ʾ����H2��__________��(��E1��E2�����ʽ�ӱ�ʾ)

��3��H2(g)��ȼ����Ϊ________��
��4���������H2(g)��Ϊ��Դ�ȼ״�������Ϊ��Դ���ŵ㣺________________(д�����㼴��)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��pKa=��lgKa��25��ʱ�����������pKaֵ���±���ʾ������˵����ȷ����
����Ļ�ѧʽ | CH3COOH | HCOOH | H2SO3 |
pKa | 4.74 | 3.74 | 1.90 7.20 |
A. ��Na2SO3��Һ�м���������ᣬ��Ӧ����SO2
B. 25��ʱ��pH=8�ļ�������Һ�У�c( HCOOH)=9.9��10��7mol��L-1
C. 25��ʱ��ij������ҺpH=a�����Ũ�ȵļ���pH=a��1
D. ��ͬ�¶��£���Ũ�ȵ� HCOONa��Һ��Na2SO3��Һ��pH��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������PbSO4��PbCO3���ܶȻ������ֱ�Ϊ1.7��![]() ��7.4��
��7.4��![]() ������˵���������
������˵���������
A. PbSO4�ı�����Һ�У�c(Pb2+)ԼΪ1.3��![]()
![]()
B. ��ӦPbSO4(s)+CO32-(aq) ![]() PbCO3(s)+SO42-(aq)��ƽ�ⳣ��ԼΪ4.4��
PbCO3(s)+SO42-(aq)��ƽ�ⳣ��ԼΪ4.4��![]()
C. ��c(CO32-)=c(SO42-)�Ļ��Һ�еμ�Pb(NO3)2��Һ���ȵõ�PbCO3����
D. PbCO3��ˮ�е��ܽ�ȱ���Pb(NO3)2��Һ�еĴ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������һ��������������£�����Ч�����ȩ�������л��Ч���־ã�����������������ij�������о�����Һ������Զ�TiO2���Ⱦ��R���ⷴӦ��Ӱ�죬�����ͼ��ʾ�������ж���ȷ����

A. ��0��20min֮�䣬pH��7ʱR�Ľ�������Ϊ0.07mol��L-1��min-1
B. R����ʼŨ�Ȳ�ͬ�����ж���Һ������Զ�R�Ľ������ʵ�Ӱ��
C. �������Ѷ�pH��2��R��Һ��Ч�ʺ�
D. ��0��50 min֮�䣬R�Ľ���ٷ���pH��2����pH��7
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com