
| A. | 氢氧化铝、碳酸钠都是常见的胃酸中和剂 | |
| B. | 高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂,既能杀菌消毒又能净水 | |
| C. | 碘酒中的碘因有还原性而起到杀菌消毒作用 | |
| D. | 高纯度的二氧化硅广泛用于制作光导纤维,光导纤维遇强酸强碱均会“断路” |
分析 A、碳酸钠的碱性过强,不能用于治疗胃酸过多;
B、K2FeO4中Fe元素化合价高,具有强氧化性,可以杀菌消毒,被还原为铁离子,铁离子水解生成氢氧化铁胶体,表面积很大,可以吸附悬浮物起净水作用;
C、碘单质有氧化性;
D、根据光导纤维的主要成分是二氧化硅以及二氧化硅能与氢氧化钠溶液反应,生成硅酸钠和水,但二氧化硅与强酸不反应.
解答 解:A、碳酸钠的碱性过强,对胃的刺激性过大,不能用于治疗胃酸过多,故A错误;
B、K2FeO4中Fe元素化合价高,具有强氧化性,可以杀菌消毒,被还原为铁离子,铁离子水解生成氢氧化铁胶体,表面积很大,可以吸附悬浮物起净水作用,故B正确;
C、碘单质有氧化性,能杀菌消毒,故C错误;
D、二氧化硅能用于制光导纤维、二氧化硅能与氢氧化钠溶液反应,生成硅酸钠和水,所以光导纤维遇强碱会“断路”,但二氧化硅与强酸不反应,不形成断路,故D错误;
故选B.
点评 本题考查了化学知识在生活中的应用,难度不大,属于识记型知识,注意归纳总结.


 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
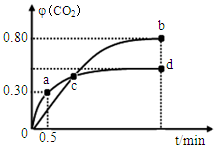 利用I2O5可消除CO污染或定量测定CO,反应为:
利用I2O5可消除CO污染或定量测定CO,反应为:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向某无色溶液中加入BaCl2溶液有白色沉淀出现,再加入稀盐酸,沉淀不消失,则该溶液中一定含有SO42- | |
| B. | 焰色反应试验中,透过蓝色钴玻璃,可观察到Na+离子火焰呈黄色 | |
| C. | 检验Na2CO3固体中是否混有NaHCO3,可向固体滴加稀盐酸,观察是否产生体 | |
| D. | 用丁达尔效应可鉴别FeCl3溶液和Fe(OH)3胶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (写结构简式).
(写结构简式).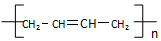 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
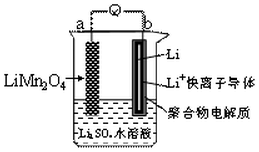 新能源汽车如(比亚迪秦、唐)相对传统汽车.有一系列的优点.如:环保、加速快(比亚迪唐0-100km/h加速时间仅需4.9秒).而新能源汽车一个核心部件为锂离子电池,如图是我国科学家报道的某种水溶液锂离子电池体系.下列叙述错误的是( )
新能源汽车如(比亚迪秦、唐)相对传统汽车.有一系列的优点.如:环保、加速快(比亚迪唐0-100km/h加速时间仅需4.9秒).而新能源汽车一个核心部件为锂离子电池,如图是我国科学家报道的某种水溶液锂离子电池体系.下列叙述错误的是( )| A. | a为电池的正极 | |
| B. | 电池充电反应为LiMn2O4═Li1-xMn2O4+xLi | |
| C. | 放电时,a极锂的化合价发生变化 | |
| D. | 放电时,溶液中Li+从b向a迁移 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com