
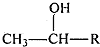
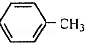
 $\stackrel{KMnO_{4},H+}{→}$
$\stackrel{KMnO_{4},H+}{→}$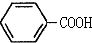
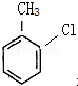 这一途径外,另一途径生成的中间产物的结构简式为
这一途径外,另一途径生成的中间产物的结构简式为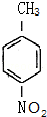 ,假定每次反应所得可能产物的机会是均等的,试分析,当消耗等量反应物时题中(填“题中”或“另一”)途径获得B的产量更高;
,假定每次反应所得可能产物的机会是均等的,试分析,当消耗等量反应物时题中(填“题中”或“另一”)途径获得B的产量更高;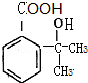 $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$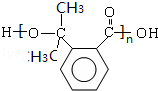 +(n-1)H2O;
+(n-1)H2O;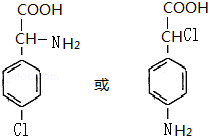 等.
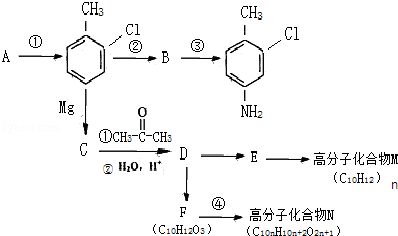
等.分析 根据题中各物质转化关系,A与氯气发生苯环上的取代生成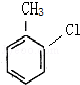 ,则A为
,则A为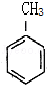 ,反应条件应为铁粉做催化剂,比较
,反应条件应为铁粉做催化剂,比较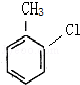 和
和 的结构,可知B为
的结构,可知B为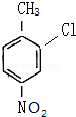 ,反应②为硝化反应,
,反应②为硝化反应,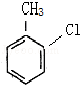 与镁反应生成C为
与镁反应生成C为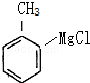 ,根据题中信息②可知D为
,根据题中信息②可知D为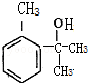 ,根据F的分子式以及生成高分子化合物N的分子式可知,F为
,根据F的分子式以及生成高分子化合物N的分子式可知,F为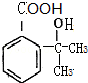 ,N为
,N为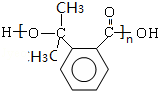 ,F发生缩聚反应生成N,
,F发生缩聚反应生成N,
据此分析解答.
解答 解:根据题中各物质转化关系,A与氯气发生苯环上的取代生成 ,则A为
,则A为 ,反应条件应为铁粉做催化剂,比较
,反应条件应为铁粉做催化剂,比较 和
和 的结构,可知B为
的结构,可知B为 ,反应②为硝化反应,
,反应②为硝化反应, 与镁反应生成C为
与镁反应生成C为 ,根据题中信息②可知D为
,根据题中信息②可知D为 ,根据F的分子式以及生成高分子化合物N的分子式可知,F为
,根据F的分子式以及生成高分子化合物N的分子式可知,F为 ,N为
,N为 ,F发生缩聚反应生成N,
,F发生缩聚反应生成N,
(1)由A合成B可有两种途径,除题中生成中间产物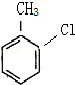 这一途径外,另一途径生成的中间产物的结构简式为
这一途径外,另一途径生成的中间产物的结构简式为 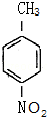 ,假定每次反应所得可能产物的机会是均等的,由于甲苯与硝酸反应硝基也有可能取代在甲基的邻位上,且有两个邻位可取代,所以当消耗等量反应物时题中途径获得B的产量更高,
,假定每次反应所得可能产物的机会是均等的,由于甲苯与硝酸反应硝基也有可能取代在甲基的邻位上,且有两个邻位可取代,所以当消耗等量反应物时题中途径获得B的产量更高,
故答案为: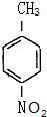 ;题中;
;题中;
(2)根据上面的分析可知,反应①的条件为铁粉做催化剂,反应②为硝化反应,要用浓硫酸作催化剂,所用试剂混合的先后顺序为先加浓硝酸再加浓硫酸,反应④的反应类型为缩聚反应,D为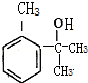 ,D的核磁共振氢谱有6条峰,
,D的核磁共振氢谱有6条峰,
故答案为:铁粉做催化剂;先加浓硝酸再加浓硫酸;缩聚反应;6;
(3)生成高分子化合物N的化学方程式为n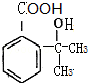

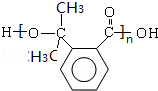 +(n-1)H2O,
+(n-1)H2O,
故答案为:n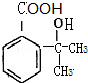

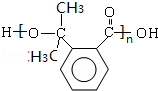 +(n-1)H2O;
+(n-1)H2O;
(4)B为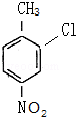 ,符合下列三个条件①分子式比B多一个“CH2”,②具有“两性”,③苯环上的一氯代物只有两种,这样的有机物的结构简式为
,符合下列三个条件①分子式比B多一个“CH2”,②具有“两性”,③苯环上的一氯代物只有两种,这样的有机物的结构简式为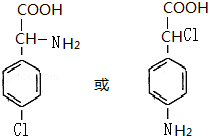 等,故答案为:
等,故答案为: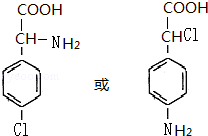 等.
等.
点评 本题考查有机物推断,为高频考点,侧重考查学生分析推断及知识综合运用能力,把握物质结构特点及其性质是解本题关键,注意题给信息的灵活运用,题目难度中等.


科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 给试管中的液体加热时,试管口不准对着别人,但可以对着自己 | |
| B. | 玻璃仪器都可以用于加热 | |
| C. | 在H2还原氧化铜的实验中,应把H2通过预先加热的氧化铜 | |
| D. | 无论给试管中的液体还是固体加热,都必须先预热 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,11.2LSO3所含原子数为2NA | |
| B. | 标况下11.2LNO和11.2LO2混合后所得气体分子数为NA | |
| C. | 0.1mol•L-1的NaHSO4溶液中,阳离子的数目之和为0.2NA | |
| D. | 1mol SiO2晶体中含有硅氧键的数目为4NA.而1mol金刚石中含碳碳键的数目为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 集气瓶中所含物质可能是纯净物 | |
| B. | 集气瓶中可能只含有两种单质 | |
| C. | 集气瓶中不可能既存在单质又存在化合物 | |
| D. | 集气瓶中可能含有一种单质和一种化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com