
| A. | 硫酸钠溶液和醋酸铅溶液均能使蛋白质变性 | |
| B. | 油脂是高级脂肪酸的甘油酯,均不能发生氢化反应 | |
| C. | H2N-CH2-COOH既能与盐酸反应、又能与氢氧化钠溶液反应 | |
| D. | 合成橡胶 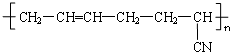 的单体之一是CH3-C≡C-CH3 的单体之一是CH3-C≡C-CH3 |
分析 A.重金属离子能使蛋白质变性而中毒;
B.有些油脂是不饱和高级脂肪酸的甘油酯;
C.H2N-能与盐酸反应;-COOH能与氢氧化钠溶液反应;
D.若是加聚产物;找单体是在碳链两两(两个碳原子)断键,如链上有双键,则有四个碳原子断键(丁二烯结构).
解答 解:A.加入少量饱和的硫酸钠溶液会发生盐析,不发生变性,故A错误;
B.有些油脂是不饱和高级脂肪酸的甘油酯,能发生氢化反应,故B错误;
C.H2N-能与盐酸反应;-COOH能与氢氧化钠溶液反应,故C正确;
D.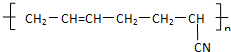 的单体是丁二烯和CH2=CH-CN,故D错误.
的单体是丁二烯和CH2=CH-CN,故D错误.
故选C.
点评 本题考查油脂、蛋白质、氨基酸、高分子化合物的性质,难度中等,注意加聚产物找单体的方法:找单体是在碳链两两(两个碳原子)断键,如链上有双键,则有四个碳原子断键(丁二烯结构).


科目:高中化学 来源: 题型:选择题
| A. | 30% | B. | 60% | C. | 40% | D. | 80% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 甲醇燃料电池(DNFC)被认为是21世纪电动汽车最佳候选动力源.
甲醇燃料电池(DNFC)被认为是21世纪电动汽车最佳候选动力源.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②③ | C. | ①④ | D. | 只有④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
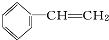 分子中,处于同一平面上的原子数最多可能16个.
分子中,处于同一平面上的原子数最多可能16个.
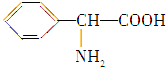 、
、 (写结构简式).
(写结构简式).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
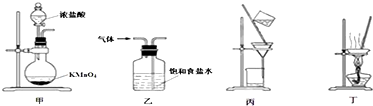
| A. | 用装置甲制取氯气 | |
| B. | 用装置乙除去氯气中的少量氯化氢 | |
| C. | 用装置丙分离二氧化锰和氯化锰溶液 | |
| D. | 用装置丁蒸发浓缩氯化锰溶液,冷却可得MnCl2•4H2O晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 黄血盐(亚铁氰化钾,K4[Fe(CN)6])易溶于水,广泛用作食盐添加剂(抗结剂),食盐中黄血盐的最大使用量为10mg•kg-1.黄血盐经长时间火炒,超过400℃时会分解生成剧毒的氰化钾.回答下列问题:
黄血盐(亚铁氰化钾,K4[Fe(CN)6])易溶于水,广泛用作食盐添加剂(抗结剂),食盐中黄血盐的最大使用量为10mg•kg-1.黄血盐经长时间火炒,超过400℃时会分解生成剧毒的氰化钾.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 室温下,氨水与氯化铵的pH=7的混合溶液中:c(Cl-)=c(NH4+) | |
| B. | 向NaHCO3溶液中加入少量NaOH固体,可抑制HCO3-的水解,使c(HCO3-)增大 | |
| C. | 0.1 mol•L-1的(NH4)2SO4溶液中:c(NH4+)>c(SO42-)>c(H+)>c(OH-) | |
| D. | 常温下,等体积pH=a的醋酸与pH=b的NaOH溶液恰好中和时,a+b=14 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com