
| A. | 甲为氯化钡 | B. | 乙溶液含有Cl- | ||
| C. | 丙溶液含有 SO42- | D. | 丁溶液含有NH4+ |
分析 ①将甲溶液分别与其他三种物质的溶液混合,可以形成白色沉淀的只有BaSO4、BaCO3、Mg(OH)2,则甲只能是Ba(OH)2;
②0.1mol/L乙溶液中c(H+)>0.1mol/L,说明乙为二元酸,只能为硫酸;
③向丙溶液中滴入AgNO3溶液有不溶于稀HNO3的白色沉淀生成,说明丙是MgCl2,则丁是NH4HCO3;
根据以上分析进行判断.
解答 解:根据②中的信息可知乙是二元酸,故乙是H2SO4;根据③中现象,可以推知丙中含有Cl-;再结合①中提供信息,甲与其它三种物质混合均产生白色沉淀,
则可推出:甲是Ba(OH)2,乙是H2SO4,丙是MgCl2,丁是NH4HCO3,
A.根据分析可知甲是Ba(OH)2,不是氯化钡,故A错误;
B.乙是H2SO4,则乙溶液中含有SO42-,故B错误;
C.丙是MgCl2,则丙溶液中不存在SO42-,故C错误;
D.丁是NH4HCO3,则丁中含有NH4+,故D正确;
故选D.
点评 本题考查常见离子的检验方法,题目难度不大,侧重考查常见离子的性质及检验方法,做题时注意题中的反应现象,找出突破口,抓住物质的性质是关键.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
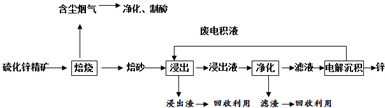

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,14g由N2与CO组成的混合气体含有的原子数目为NA | |
| B. | 标准状况下,22.4L盐酸含有NA个HC1分子 | |
| C. | 1Lmol•L-1的NaC1O溶液中含有C1O-的数目为NA | |
| D. | 1molNa被完成氧化生成Na2O2,失去个2NA电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{m-n}{3}$mL | B. | $\frac{n-m}{3{M}_{1}}$ | C. | $\frac{4m-1}{13}$mL | D. | $\frac{3}{m-n}$mL |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
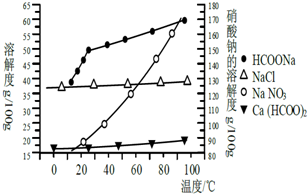 甲酸钙广泛用于食品、化工、石油等工业生产上,300~400℃左右分解.
甲酸钙广泛用于食品、化工、石油等工业生产上,300~400℃左右分解.| 金属 离子 | 开始沉淀 的pH | 沉淀完全的pH |
| Fe3+ | 1.1 | 3.2 |
| Al3+ | 3.0 | 5.0 |
| Fe2+ | 5.8 | 8.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHSO4 | B. | Al2(SO4)3 | C. | NaOH | D. | HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③⑤ | B. | ③⑥ | C. | ①② | D. | ⑤⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al3+、Fe3+、SO42- | B. | Na+、[Al(OH)4]-、CO32- | ||
| C. | Na+、[Al(OH)4]-、SO42-、CO32- | D. | Na+、Ba2+、[Al(OH)4]- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com