
| A. | H+、Ba2+、ClO-、SO42- | B. | Fe3+、H+、SO42-、I- | ||
| C. | Cu2+、NO3-、HCO3-、OH- | D. | K+、Ba2+、NO3-、Cl- |
分析 无色溶液时可排除 Cu2+、Fe2+、Fe3+、MnO4-等有色离子的存在,
A.钡离子与硫酸根离子反应生成硫酸钡沉淀、氢离子与次氯酸根离子生成次氯酸;
B.铁离子具有氧化性,能够氧化碘离子;
C.铜离子为有色离子,且铜离子能够与碳酸氢根离子、氢氧根离子反应,碳酸氢根离子与氢氧根离子反应;
D.四种离子之间不反应,能够大量共存.
解答 解:溶液无色时可排除 Cu2+、Fe2+、Fe3+、MnO4-等有色离子的存在,
A.H+与ClO-,Ba2+与SO42-之间反应,在溶液中不能大量共存,故A错误;
B.Fe3+、I-之间发生氧化还原反应,在溶液中不能大量共存,故B错误;
C.Cu2+为有色离子,且能够与HCO3-、OH-发生反应,HCO3-、OH-之间反应生成碳酸根离子和水,在溶液中不能大量共存,故C错误;
D.K+、Ba2+、NO3-、Cl-之间不发生反应,在溶液中能够大量共存,故D正确;
故选D.
点评 本题考查离子共存的判断,题目难度中等,注意掌握离子反应发生条件,明确离子不能大量共存的一般情况,如:能发生复分解反应的离子之间,能发生氧化还原反应的离子之间,能发生络合反应的离子之间(如 Fe3+和 SCN-)等;还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;溶液的颜色,如无色时可排除 Cu2+、Fe2+、Fe3+、MnO4-等有色离子的存在等.


 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | F2、Cl2、Br2、I2的熔点、沸点逐渐升高 | |
| B. | Li、Na、K、Rb熔沸点依次减弱 | |
| C. | 金刚石的硬度、熔点、沸点都高于晶体硅 | |
| D. | NaF、NaCl、NaBr、NaI的熔点依次降低 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
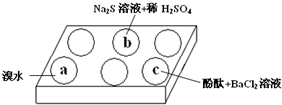 在白色点滴板上进行Na2SO3 的性质实验探究.如图所示,a、b、c三个凹槽中滴有Na2SO3 溶液,再分别滴加下图所示的试剂:
在白色点滴板上进行Na2SO3 的性质实验探究.如图所示,a、b、c三个凹槽中滴有Na2SO3 溶液,再分别滴加下图所示的试剂:| n(SO3 2-):n(HSO3-) | 91:9 | 1:1 | 9:91 |
| pH | 8.2 | 7.2 | 6.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若化合物M其原子个数比为14:4:5:1:1,则其化学式为[Cu(NH3)4]SO4•H2O | |
| B. | 若该化合物为配合物,则E离子给出孤对电子 | |
| C. | C元素与D元素形成的一种具有较强还原性的分子的VSEPR模型为平面三角形 | |
| D. | DC42-空间构型为正四面体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 纯净物 | B. | 混合物 | C. | 单质 | D. | 化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
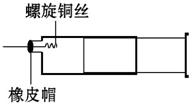 某同学采用如图装置进行实验,证明了铜与稀硝酸反应生成了NO.实验时,先向注射器内加入一定量的稀硝酸,排净注射器内的空气,迅速将带有铜丝的橡皮帽盖上,一段时间后,注射器内有无色气体产生.
某同学采用如图装置进行实验,证明了铜与稀硝酸反应生成了NO.实验时,先向注射器内加入一定量的稀硝酸,排净注射器内的空气,迅速将带有铜丝的橡皮帽盖上,一段时间后,注射器内有无色气体产生.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol铁在氯气中完全反应失去的电子数为0.2NA | |
| B. | 常温常压下,1L 0.1mol•L-1氯化铝溶液中含有0.3 NA个Cl- | |
| C. | 标准状况下,22.4L氨水中含有NA个NH3分子 | |
| D. | 常温常压下,24g镁条投入足量稀硫酸中生成22.4L H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
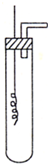 某学习小组为证明并观察铜与稀HNO3反应的产物是NO,设计了如图所示的
某学习小组为证明并观察铜与稀HNO3反应的产物是NO,设计了如图所示的查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入水中,浮在水面上的是地沟油 | |
| B. | 测定沸点,有固定沸点的是矿物油 | |
| C. | 点燃,能燃烧的是矿物油 | |
| D. | 加入含酚酞的氢氧化钠溶液,加热,红色变浅或消失的是地沟油 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com